Капните натрий в воду, и произойдет бурная, даже взрывоопасная реакция. Но для объяснения этого нужна квантовая физика.

Ключевые выводы
- Возьмите кусок металлического натрия и намочите его или бросьте в воду, и он не только шипит и выделяет тепло, но даже может вызвать пламя и взрывы.
- Легко сказать, "это просто химическая реакция", но эта реакция на атомном и молекулярном уровне подчиняется законам квантовой физики.
- Это связано с энергией ионизации и с тем, насколько легко натрий теряет электрон по сравнению с водой, водородом или кислородом. В результате получилось захватывающее зрелище природы.
Это немного парадоксально: когда мы впервые сталкиваемся с чем-то неожиданным, мы удивляемся, почему это происходит именно так. Но если мы сталкиваемся с явлением достаточно часто, даже если оно должно нас удивлять и требовать объяснения, мы просто принимаем, что мир устроен именно так.
Бросьте кристалл соли - простой хлорид натрия - в воду, и он просто растворится.
Добавьте немного хлора в воду, и вы сможете продезинфицировать ее: убить бактерии, вирусы и другие болезнетворные микроорганизмы, присутствующие внутри.
А если натрий капнуть в воду? Последовавшая за этим реакция легендарна по своей жестокости.
Как только вы намочите этот кусок металла, реакция начнет шипеть и нагреваться, натрий подпрыгивает на поверхности воды, и даже возникает пламя. Конечно, это просто химия. Но на фундаментальном уровне есть нечто большее: между металлическим натрием и молекулами воды (и его диссоциированными ионами) происходят квантовые взаимодействия, которые могут возникнуть немедленно. Хотя заманчиво сказать «это всего лишь химия», физическая причина этой реакции увлекательна и информативна, напоминая нам, что мы должны сохранять любопытство даже к мирским явлениям, к которым мы привыкли во Вселенной.
Хотя есть много способов думать об атомах, химические реакции, которые происходят между натрием и водой, имеют наибольший смысл, если вы думаете об атомах как о «благородных газах» с дополнительными протонами в их ядре и дополнительным электроны на своих валентных оболочках. Натрий, например, очень похож на благородный газ неон, десятый элемент периодической таблицы, который имеет десять протонов в ядре и имеет как первый (1s, с двумя электронами), так и второй (2s, с двумя электронами, и 2p, с шестью электронами) орбитали, заполненные всего десятью электронами.
Благородные газы славятся тем, что ни с чем не реагируют, и причина этого в том, что все его занятые атомные орбитали полностью заполнены электронами. Эта сверхстабильная конфигурация разрушается, когда вы поднимаетесь на один элемент вверх в периодической таблице, и это происходит со всеми элементами, которые соответствуют этому шаблону, включая натрий. С одним дополнительным протоном в его ядре эти заполненные электронные орбитали удерживаются более крепко, но тогда последний дополнительный валентный электрон удерживается очень слабо. Гелий сверхстабилен, а литий очень реактивен. Неон стабилен, а натрий реактивен. И аргон, криптон и ксенон стабильны, но калий, рубидий и цезий реакционноспособны.
Периодическая таблица элементов отсортирована в том виде, в каком она есть (в периодах, подобных строкам, и в группах, подобных столбцам) из-за количества свободных/занятых валентных электронов, которое является фактором номер один в определении химические свойства каждого атома. Атомы могут соединяться в самые разные молекулы, но именно электронная структура каждого из них в первую очередь определяет возможные, вероятные и энергетически выгодные конфигурации.
Причина крайней реактивности? Это лишний электрон.
Когда мы узнаем об атомах, мы учимся думать о ядре как о твердом, маленьком, положительно заряженном ядре в центре, а об электронах как об отрицательно заряженных точках, вращающихся вокруг него. Но в квантовой физике это еще не все. Электроны могут вести себя как точки, особенно если вы направите в них другую высокоэнергетическую частицу или фотон, но если предоставить их самим себе, они расползутся и будут вести себя как волны. Эти волны могут настроить себя определенным образом:
- сферически (для s -орбиталей, каждая из которых занимает по 2 электрона),
- перпендикулярно (для p -орбиталей, каждая из которых занимает по 6 электронов),
- и так далее вверх по d -орбиталям (принимая 10 электронов),
- f -орбитали (принимая 14),
и далее, следуя схеме, впервые выявленной Менделеевым.
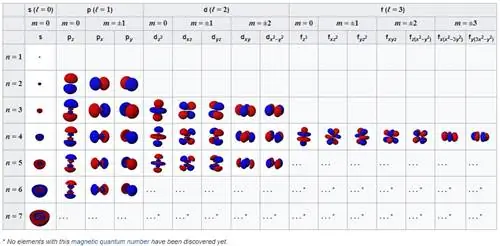
Атомные орбитали в их основном состоянии (вверху слева) вместе со следующими состояниями с наименьшей энергией по мере продвижения вправо, а затем вниз. Эти фундаментальные конфигурации управляют поведением атомов и проявлением межатомных сил.
Причины заполнения этих оболочек связаны с принципом запрета Паули, который не позволяет любым двум идентичным фермионам (например, электронам) занимать одно и то же квантовое состояние. Поскольку электроны обладают фундаментальным квантово-механическим свойством, называемым спином - мерой собственного углового момента электрона - и спин электрона может быть либо +½, либо -½, каждое уникальное квантовое состояние может иметь внутри себя два электрона: один со спином +½ и тот, что спин -½.
В атоме, как только электронная оболочка или орбиталь полностью заполняется, единственное место, куда можно поместить дополнительный электрон, находится на следующей орбитали. Атом, подобный хлору или фтору, с готовностью примет дополнительный электрон, поскольку ему требуется только еще один электрон, чтобы заполнить его электронную оболочку; и наоборот, атом натрия или калия легко отдаст свой последний электрон, поскольку у него есть один дополнительный электрон по сравнению с тем, что заполнит оболочку. Вот почему хлорид натрия (NaCl) является такой хорошей солью: натрий отдает электрон хлору, и оба атома впоследствии существуют в более энергетически выгодной конфигурации.
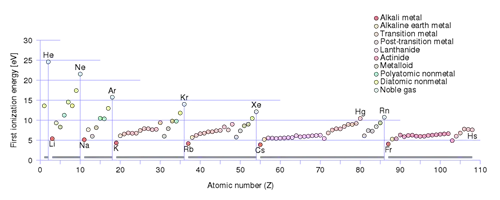
Этот график показывает первую энергию ионизации каждого атома в периодической таблице по атомному номеру. Именно столько энергии требуется, чтобы полностью отделить наиболее свободно удерживаемый электрон от атома и ионизировать его. Элементы первой группы периодической таблицы, особенно литий, натрий, калий, рубидий и т. д., теряют свой первый электрон гораздо легче, чем любые другие элементы.
На самом деле, количество энергии, необходимое для того, чтобы нейтральный атом отдал свой самый внешний электрон, известное как его первая энергия ионизации, особенно мало для всех металлов с одним валентным электроном. Если вы посмотрите на цифры, то оторвать один электрон у лития, натрия, калия, рубидия, цезия и т. д. гораздо проще, чем у любого другого элемента.
Более того, по мере того, как мы обращаемся к более тяжелым элементам - элементам с большим числом протонов в ядре в целом и, следовательно, с большим числом полностью заполненных орбиталей, - мы обнаруживаем, что общая энергия ионизации резко уменьшается.
Это свойство играет важную роль, хотите верьте, хотите нет, в формировании новых звезд. Когда сформировались первые звезды, Вселенная состояла только из трудно поддающихся ионизации водорода и гелия, поэтому, если вы не нагрели эти элементы до температуры, достаточной для их ионизации, они очень медленно охлаждали газовые облака. Это приводит к образованию облаков большой массы, из которых образуются звезды с большей массой; позже во Вселенной, когда будет больше тяжелых элементов, охлаждение происходит гораздо легче из-за обилия более легко ионизируемых молекул. Более поздние звезды могут образовываться из облаков с меньшей массой, что приводит к звездам с меньшей массой, чем их ранние, более нетронутые аналоги.
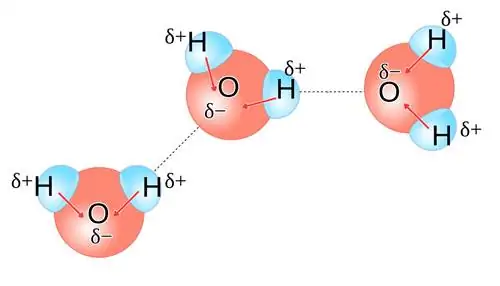
Это иллюстрирует взаимодействие молекул воды друг с другом. Вода представляет собой молекулу V-образной формы с отрицательно заряженной стороной (где находится атом кислорода) и положительно заряженными концами там, где находятся атомы водорода. Соседние молекулы воды взаимодействуют друг с другом посредством водородных связей, изображенных на этом рисунке пунктирными линиями.
Так что же тогда происходит, когда вы приводите атом натрия - легко ионизуемый атом натрия, который относительно слабо удерживает только свой самый внешний электрон - в присутствии воды?
У вас может возникнуть соблазн думать о воде как об отдельной очень стабильной молекуле: H2O, с двумя атомами водорода, связанными с одним атомом кислорода.. Но вода - высокополярная молекула, а это означает, что одна сторона молекулы H2O (сторона, обращенная в сторону от двух атомов водорода) имеет преимущественно отрицательный заряд, в то время как противоположная сторона имеет преимущественно положительный заряд.
Это означает, что у каждой молекулы воды есть «отрицательно заряженный» конец, где находится кислород, и «положительно заряженный» конец напротив него. Когда у вас есть жидкая вода, эти молекулы выстраиваются относительно друг друга таким образом, что электрическая потенциальная энергия минимизируется, и отрицательный конец одной молекулы воды с большей вероятностью притянется к положительному концу других молекул воды. Это достаточно значительный эффект, который заставляет некоторые молекулы воды - примерно одну из нескольких миллионов или около того - диссоциировать на два иона: один протон (H+) и ион гидроксила (OH-).

В присутствии большого количества чрезвычайно полярных молекул воды одна из каждых нескольких миллионов молекул воды расщепляется на гидроксильные ионы и свободные протоны посредством процесса, известного как автопротолиз.
Это имеет множество последствий для таких вещей, как кислоты и основания, растворение солей, активация химических реакций и т. д. Но что происходит, когда у вас есть даже чистая вода, состоящая не только из H 2O, но также содержащие небольшой (чуть меньше 0,0001%) процент обоих протонов (H+) и ионы гидроксила (OH-), а затем вы добавляете к нему нейтральный натрий?
Натрий, этот нейтральный атом со свободно удерживаемым крайним электроном, теперь находится в присутствии воды: нейтральной, но полярной воды, свободных протонов и ионов гидроксила. Тогда мы должны спросить, какая конфигурация является наиболее энергетически выгодной?
- Отдаст ли натрий свой крайний электрон нейтральной воде?
- Отдаст ли натрий свой внешний электрон иону гидроксила?
- Отдаст ли натрий свой крайний электрон свободному протону?
- Или натрий сохранит свой внешний электрон или даже получит электрон от одной из других частиц?
Ответ очевиден; практически в каждом случае электрон перепрыгнет с атома натрия на первый найденный протон.
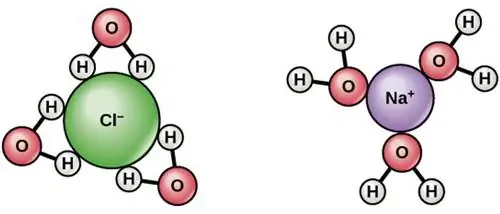
Потеряв электрон, ион натрия с радостью растворится в воде, как и ион хлорида, получив электрон. В случае натрия гораздо более энергетически выгодно, чтобы этот электрон вместо этого спарился с ионом водорода (то есть со свободным протоном).
На самом деле, это даже не конкурс. В масштабе отдельных атомов и ионов мы обычно думаем об ответах на такие вопросы, как «Сколько энергии требуется для ионизации электрона?» или «Сколько энергии высвобождается, когда электрон находит ион и образует нейтральный атом в основном состоянии?» в энергиях по шкале электрон-вольт (эВ). Для ионизации нейтрального атома натрия требуется чуть более 5 эВ энергии, и когда ион натрия получает электрон, он высвобождает те же ~5 эВ энергии. Но для ионизации нейтрального водорода требуется более 13 эВ энергии, и те же самые 13,6 эВ энергии высвобождаются, когда ион водорода снова становится нейтральным.
Вот почему реакция происходит так быстро, когда металлический натрий падает в воду, и почему он выделяет так много энергии. Фактически, по мере того как электроны, отдаваемые натрием, начинают соединяться с ионами водорода, нейтральная вода далее диссоциирует на свободные протоны и ионы гидроксила, создавая еще больше «топлива» для реакции натрия.
Но и это еще не конец истории. Теперь, когда мы создали нейтральные атомы водорода, они не просто образуют блок отдельных атомов, которые можно связать вместе, как это делает металлический натрий. Вместо этого при комнатных температурах и давлениях водород представляет собой газ и переходит в еще более энергетически выгодное состояние: образуя нейтральную молекулу водорода, H2 Итак, теперь, у вас есть много свободной энергии (которая идет на тепло окружающих молекул), нейтральный газообразный водород, и он поднимается из водного раствора в атмосферу, которая в основном состоит из нейтрального азота (N 2) и кислород (O2) газы.

Удаленная камера снимает крупный план главного двигателя космического корабля "Шаттл" во время испытательных пусков в Космическом центре Джона Стенниса. Водород предпочтительнее в качестве источника топлива для ракет из-за его низкой молекулярной массы и большого количества кислорода в атмосфере, с которым он может реагировать.
Вы узнаете этот рецепт?
У вас много свободной энергии в виде тепла. У вас есть газообразный молекулярный водород и газообразный молекулярный кислород.
Это верный рецепт возгорания! Сгорание водорода/кислорода является ключевым компонентом ракетного топлива, транспортных средств на водородных топливных элементах и знаменитой катастрофы Гинденберга. (Вот почему сегодня мы наполняем дирижабли инертным гелием вместо горючего водорода!)
Когда кислород и водород реагируют в присутствии энергии, эта огненная реакция горения производит водяной пар, но также выделяет еще больше энергии. Это объясняет, почему, когда вы бросаете достаточно большой кусок натрия (или любого элемента группы 1 из таблицы Менделеева) в воду, вы получаете такой колоссальный взрывной выброс энергии. Все это обусловлено переносом электронов, который происходит благодаря квантовым законам, управляющим Вселенной, и электромагнитным свойствам заряженных частиц, из которых состоят эти атомы и ионы.
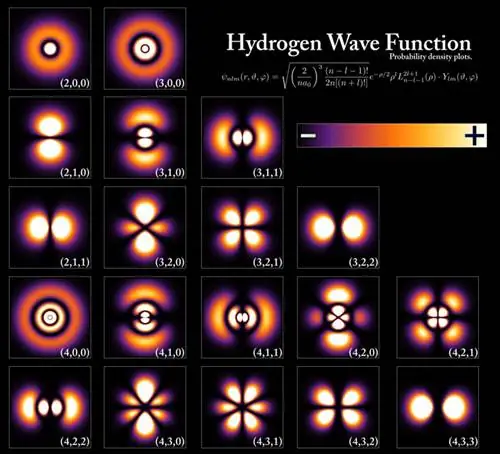
Энергетические уровни и волновые функции электрона, которые соответствуют различным состояниям внутри атома водорода, хотя конфигурации для всех атомов очень похожи. То, как атомы связываются друг с другом, образуя молекулы и другие, более сложные структуры, является сложной задачей, когда вы начинаете с фундаментальных частиц и взаимодействий, но понимание основ - это то, как мы приближаемся к объяснению более сложных систем.
Итак, если вы бросите кусок натрия в воду, вот что произойдет.
- Во-первых, натрий немедленно отдает свой внешний электрон водному раствору, то есть воде.
- Далее этот электрон поглощается ионом водорода, образуя нейтральный атом водорода.
- Эта начальная реакция высвобождает большое количество свободной энергии, заставляя окружающие молекулы нагреваться.
- Сразу после этого нейтральные атомы водорода соединяются вместе, быстро образуя большое количество молекулярного газообразного водорода.
- Водород намного легче и менее плотный, чем другие атмосферные газы, поэтому он поднимается из водного раствора.
- И, наконец, если энергии достаточно, кислород атмосферы вступает в реакцию с газообразным водородом, вызывая реакцию горения.

Блок металлического натрия, как показано здесь, выглядит довольно непримечательно. Но вы не должны касаться его голыми руками, и вы не должны мочить его, если вы не готовы к последствиям. Натрий очень активно взаимодействует с водой, и результаты часто могут быть взрывоопасными.
Это будет продолжаться до тех пор, пока весь металлический натрий не исчезнет, или, точнее, пока натрий полностью не растворится в ионизированной форме в оставшейся воде. Это не просто химия в действии; это фундаментальная наука квантовой физики, которая делает все это возможным.
Сами правила, управляющие протеканием каждой из этих химических реакций, вытекают из еще более фундаментальных законов:
- из квантовой физики, включая правило запрета Паули, которое регулирует поведение электронов в атомах,
- и классического электромагнетизма, который определяет взаимодействие заряженных частиц.
Нечасто удается вывести полное поведение сложной системы из простых фундаментальных законов, лежащих в основе составляющих ее компонентов, но в случае реакции натрия с водой мы можем сделать именно это. Без этих физических законов и сил у нас вообще не было бы химии! Тем не менее, благодаря им каждый раз, когда вы добавляете натрий в воду, вы точно знаете, чего ожидать. И если вы все еще не знаете, чего ожидать, когда капнете натрий в воду, ответ - наденьте защитные средства, не беритесь за натрий руками, содержащими воду, и отойдите на безопасное расстояние, пока идет реакция. имеет место!
