Белковые фибриллы накапливаются в мозге во время нейродегенерации. Криоэлектронная микроскопия обнаружила фибриллы неожиданного белка.

Ключевые выводы
- Белковые фибриллы накапливаются в мозге во время нейродегенерации.
- Исследования показали, что белок TDP-43 образует агрегаты фибрилл, что, возможно, приводит к дегенерации лобно-височных долей.
- Теперь криоэлектронная микроскопия выявила присутствие ранее неизвестной белковой фибриллы в больном мозге.
Мозг, возможно, является худшим местом для обнаружения неожиданного скопления белков, поскольку они являются явным признаком нейродегенеративного заболевания. По мере того, как нерастворимые белки объединяются в мозге, образуя длинные волосовидные волокна, неврологическая функция снижается.
Хотя роль этих фибрилл остается загадкой, исследователи и врачи используют их для характеристики заболеваний. Кроме того, знание точной структуры белков, образующих фибриллы, имеет решающее значение для разработки эффективных методов лечения нейродегенеративных заболеваний, включая вакцины. Например, при болезни Альцгеймера образуются бета-амилоидные фибриллы. В 2021 году группа исследователей обнаружила в белках особую структуру, которая позволила им разработать вакцину против болезни, подобной болезни Альцгеймера, у мышей.
Надеясь найти новые способы лечения нейродегенеративных расстройств, две независимые группы ученых - одну во главе с Дэвидом Айзенбергом, а другую - Сьером Шересом и Мишелем Гедертом - исследовали структуру белков, вовлеченных в тип нейродегенеративных заболеваний. деменция, называемая лобно-височной долевой дегенерацией (FTLD). Они обнаружили в головном мозге ранее неизвестную белковую фибриллу. Хотя обе группы идентифицировали один и тот же белок с помощью схожих методов, они пришли к совершенно разным выводам о его релевантности.
TDP-43: ожидаемый белок в больном мозгу
Половина всех случаев FTLD характеризуется нерастворимыми отложениями ДНК-связывающего белка, называемого TDP-43. Как выразился Дерек Лоу, автор журнала Science, «TDP43 сама по себе - интересный зверь». Несмотря на свое название, профиль связывания TDP-43 с РНК гораздо более впечатляющий, чем его связывание с ДНК. Согласно предыдущим исследованиям, белок может связываться с более чем 6000 различных РНК-мишеней, что составляет почти 30% всей РНК человека. Кроме того, этот белок взаимодействует с несколькими мощными белками, включая ядерный фактор каппа-В (древний регулятор врожденной иммунной системы) и пару белков теплового шока (которые предотвращают разрушение других белков в стрессовых условиях).
Следовательно, неудивительно, что этот белок обнаруживается в больном мозге. Ученые обнаружили агрегаты TDP-43 при четырех нейродегенеративных заболеваниях: FTLD, боковом амиотрофическом склерозе (БАС), первичном боковом склерозе и прогрессирующей мышечной атрофии. Однако структура фибрилл TDP-43 так и не была определена.
Пытаясь разрешить структуры TDP-43 в мозге пациентов с FTLD (и найти способы лечения), команда Айзенберга использовала метод, называемый криоэлектронной микроскопией (крио-ЭМ). Хотя крио-ЭМ - это метод, которому уже несколько десятилетий, он вызывает все больший интерес среди молекулярных биологов и биохимиков. В 2013 году серия технологических и алгоритмических прорывов, описанных как «революция разрешения», значительно улучшила разрешение, получаемое с помощью этого метода. В 2020 году исследователи впервые использовали эту технологию для обнаружения отдельных атомов в белке.
Команда Шереса также использовала крио-ЭМ в своем исследовании, но TDP-43 их не интересовала. Вместо этого они изучали белок под названием TMEM106B. Как оказалось, группа Айзенберга также изучала TMEM106B; они просто еще этого не знали.
TMEM106B: неожиданный белок в больном мозге
TMEM106B - это белок, участвующий в системе управления клеточными отходами. Около десяти лет назад ученые обнаружили, что определенные генетические вариации TMEM106B повышают риск развития FTLD. Однако эксперименты не смогли обнаружить фибриллы TMEM106B в больном мозге. Однако команды Шереса и Айзенберга нашли фибриллы, хотя и не искали их.
Команда Айзенберга выделила фибриллы, обнаруженные в мозге четырех пациентов с FTLD, полагая, что фибриллы в основном состоят из TDP-43. Однако когда они проанализировали атомную структуру белков, стало ясно, что они идентифицировали что-то неизвестное. Исследователи сравнили их неизвестную структуру с другими человеческими белками и нашли только одно совпадение: TMEM106B, который ранее никогда не обнаруживался в фибриллах. Они также обнаружили большое количество TDP-43, но он не образовывал фибриллоподобных скоплений, связанных с нейродегенерацией. Таким образом, команда пришла к выводу, что фибриллы TMEM106B являются характерным FTLD.
Команда Шереса также обнаружила фибриллы TMEM106B в мозге людей, умерших от FTLD, а также ряда других нейродегенеративных заболеваний, включая БАС. Однако они также обнаружили фибриллы в мозгу здоровых пожилых людей. Следовательно, они пришли к выводу, что фибриллы TMEM106B накапливаются в процессе старения и могут не иметь отношения к заболеванию.
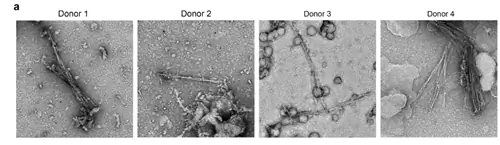
Открытие новых возможностей для расследования
Даже если фибриллы TMEM106B не вызывают заболевания, их открытие, безусловно, не лишено смысла. Риск развития нейродегенеративного заболевания увеличивается с возрастом. Если фибриллы TMEM106B накапливаются с возрастом, то возможно, что накопление фибрилл TMEM106B вызывает нейродегенерацию посредством других факторов. Независимо от роли TMEM106B в возникновении заболевания, эта структура открывает новые возможности для исследований.
