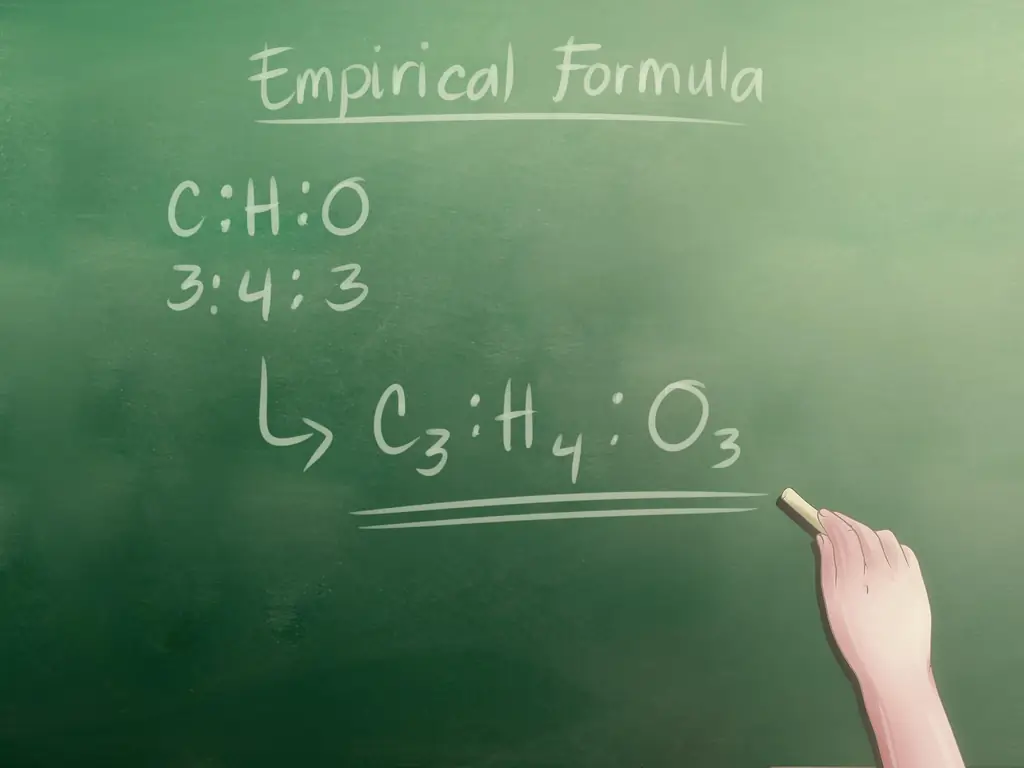Если вам было предложено домашнее задание, где вы должны найти эмпирическую формулу соединения, но вы не знаете, с чего начать, не бойтесь! wikiHow здесь, чтобы помочь! Сначала ознакомьтесь с базовыми знаниями, необходимыми для поиска эмпирической формулы, а затем рассмотрите пример в Части 2.
Шаги
Метод 1 из 2: понимание основ

Шаг 1. Узнайте, что такое эмпирическая формула
В химии EF - это самый простой способ описать соединение - это, по сути, список элементов, составляющих соединение, упорядоченный в процентах. Важно отметить, что эта простая формула не описывает расположение атомов внутри соединения, она просто указывает, из каких элементов состоит соединение. Например:
Соединение, состоящее из 40,92% углерода, 4,58% водорода и 54,5% кислорода, будет иметь эмпирическую формулу C3ЧАС4О3 (мы рассмотрим пример того, как найти EF этого соединения во второй части).

Шаг 2. Понять термин «процентный состав»
«Процентный состав» относится к проценту каждого отдельного атома во всем соединении, на которое мы смотрим. Чтобы найти эмпирическую формулу соединения, мы должны знать процентный состав соединения. Если вы найдете эмпирическую формулу для домашнего задания, вам, скорее всего, дадут проценты.
В химической лаборатории, чтобы определить процентный состав, соединение будет исследовано с помощью физических экспериментов, а затем количественного анализа. Если вы не находитесь в лаборатории, вам не нужно будет проводить эти эксперименты

Шаг 3. Имейте в виду, что вы будете иметь дело с грамм-атомами
Грамм-атом - это определенное количество элемента, вес которого в граммах равен его атомной массе. Чтобы найти грамм-атом, уравнение: Процент элемента в соединении (%), деленный на атомную массу элемента.
Например, предположим, что у нас есть соединение, состоящее из 40,92% углерода. Атомная масса углерода равна 12, поэтому наше уравнение будет 40,92 / 12 = 3,41

Шаг 4. Узнайте, как найти атомное соотношение
Когда вы работаете с составом, вам нужно будет вычислить более одного атома грамма. После того, как вы найдете все грамм-атомы в своем соединении, посмотрите на них все. Чтобы найти атомное соотношение, вам нужно будет выбрать грамм-атом, который является наименьшим из всех грамм-атомов, которые вы рассчитали. Затем вы разделите все ваши грамм-атомы на наименьший грамм-атом. Например:
- Допустим, мы работаем с соединением, которое имеет три грамма атома: 1,5, 2 и 2,5. Наименьший грамм-атом из этих трех чисел равен 1,5. Итак, чтобы найти атомное соотношение, вы должны разделить все числа на 1,5, а затем разделить их символом отношения :
- 1,5 / 1,5 = 1,2 / 1,5 = 1,33. 2,5 / 1,5 = 1,66. Итак, ваше атомное соотношение 1: 1.33: 1.66.
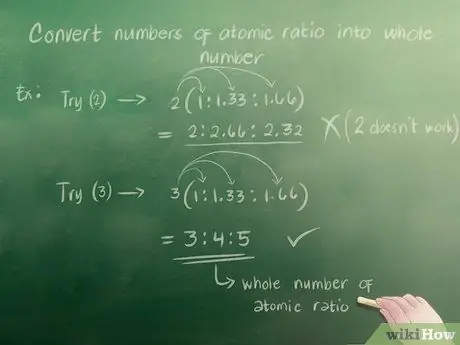
Шаг 5. Понять, как преобразовать числа атомного отношения в целые числа
При написании эмпирической формулы вам нужны целые числа. Это означает, что вы не можете использовать число вроде 1,33. После того, как вы нашли атомное соотношение, вам нужно преобразовать любые частичные числа (опять же, например, 1,33) в целые числа (например, 3). Для этого вам нужно найти целое число, которое можно умножить на каждое отдельное число в вашем атомном соотношении, чтобы получить целое число. Например:
- Попробуйте 2. Умножьте числа в вашем атомном соотношении (1, 1,33 и 1,66) на 2. Вы получите 2, 2,66 и 3,32. Это не целые числа, поэтому 2 не работает.
- Попробуйте 3. Вы получите 3, 4 и 5, когда умножите 1, 1,33 и 1,66 на 3. Следовательно, ваше атомное отношение целых чисел 3: 4: 5.

Шаг 6. Понять, что означают эти целые числа для эмпирической формулы
Целочисленное отношение, которое мы только что решили, фактически соответствует эмпирической формуле. Эти три целых числа - маленькие числа, которые висят у подножия каждой буквы, представляющей отдельный элемент соединения. Например, наша выдуманная эмпирическая формула будет выглядеть так:
Икс3Y4Z5
Метод 2 из 2: поиск эмпирической формулы
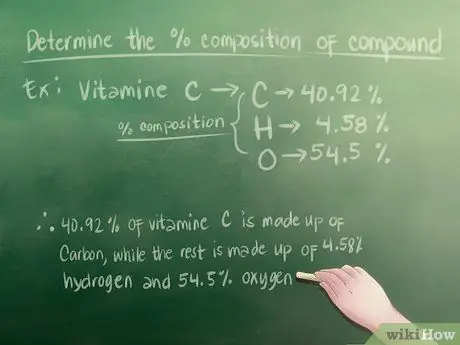
Шаг 1. Определите процентный состав вашего соединения
Если вы пытаетесь найти эмпирическую формулу для домашнего задания, вам, скорее всего, дадут процентный состав - вам просто нужно знать, где искать. Например:
- Допустим, в задании вас просят взглянуть на образец витамина С. В нем указано 40,92% углерода, 4,58% водорода и 54,5% кислорода - это процентный состав.
- 40,92% витамина С состоит из углерода, а остальная часть состоит из 4,58% водорода и 54,5% кислорода.

Шаг 2. Найдите количество грамм-атомов в соединении
Как обсуждалось в Части 1, уравнение для определения количества грамм-атомов выглядит следующим образом: Процент элемента в соединении (%), деленный на атомную массу элемента.
В нашем примере атомная масса углерода равна 12, водорода - 1, а кислорода - 16.
- Количество грамм-атомов углерода = 40,92 / 12 = 3,41
- Количество грамм-атомов водорода = 04,58 / 01 = 4,58
- Количество грамм-атомов кислорода = 54,50 / 16 = 3,41

Шаг 3. Определите атомное соотношение
Найдите грамм-атом, который является наименьшим из всех грамм-атомов, которые мы только что вычислили. В нашем примере это 3,41 (углерод или кислород - оба имеют одинаковое значение). Затем вы должны разделить все значения грамм-атома на это число. Вы пишете соотношение так: значение Углерод: значение Водород: значение Кислород.
- Углерод: 3,41 / 3,41 = 1
- Водород: 4,58 / 3,41 = 1,34
- Кислород: 3,41 / 3,41 = 1
- Атомное соотношение 1: 1.34: 1.
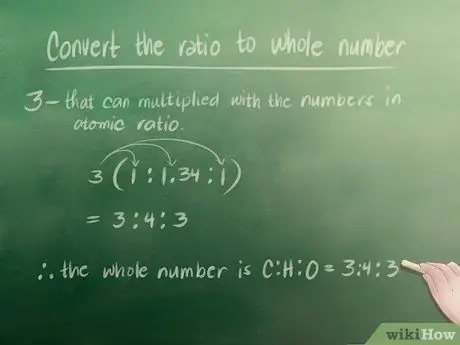
Шаг 4. Преобразуйте отношение в целые числа
Если в вашем атомном соотношении есть целые числа, вы можете пропустить этот шаг. Однако в нашем примере мы должны преобразовать 1,34 в целое число. Наименьшее целое число, которое можно умножить на числа в нашем атомном соотношении, чтобы получить целые числа, равно 3.
- 1 x 3 = 3 (это работает, потому что 3 - целое число).
- 1,34 х 3 = 4 (4 тоже целое число).
- 1 x 3 = 3 (опять же, 3 - целое число).
- Следовательно, наше целое числовое соотношение - Углерод (C): Водород (H): Кислород (O) = 3: 4: 3
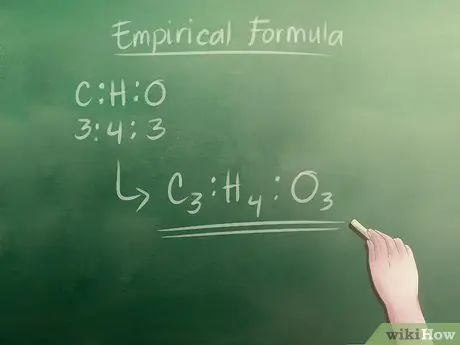
Шаг 5. Запишите эмпирическую формулу
Для этого все, что вам нужно сделать, это написать буквы каждого компонента, в данном случае C для углерода, H для водорода и O для кислорода, с их счетными частями целого числа в качестве индексов. Эмпирическая формула для нашего примера:
C3ЧАС4О3
подсказки
- Молекулярная формула представляет собой общее количество присутствующих элементов, тогда как эмпирическая формула представляет собой наименьшее соотношение между отдельными атомами.
- Если бы вам нужно было найти процентные составы в лаборатории, вы бы использовали спектрометрические эксперименты с образцом соединения.