Атомы соединяются вместе, образуя молекулы, разделяя электроны, и это разделение электронов иногда может быть равным (или почти равным). В других случаях у одного атома в среднем больше электронов. Когда один атом имеет непропорциональное количество отрицательного заряда (электронов), это означает, что другой атом будет иметь положительный заряд. Это делает связь полярной, что означает наличие положительного и отрицательного полюсов. Вы можете идентифицировать полярные связи, глядя на типы атомов, связанных вместе, и электроотрицательность этих атомов. Затем вы можете классифицировать связь как полярную или неполярную.
Шаги
Метод 1 из 4: изучение связанных атомов

Шаг 1. Определите любые металлы
Металлы обычно блестящие и податливые. У них часто есть слабосвязанные электроны. Это означает, что они имеют более слабую электроотрицательность, чем многие неметаллы. Это позволяет металлам «отдавать» часть своих электронов неметаллам, что приводит к диполю.
Диполь - это когда связь имеет положительный и отрицательный заряд на обоих концах. Наличие диполя указывает на полярную связь

Шаг 2. Обратите внимание на неметаллы
Неметаллы обычно твердые и хрупкие, им не хватает блеска (блеска). Часто они обладают большей электроотрицательностью, чем металлы. Это означает, что они могут «забирать» электроны у атомов металла, с которыми они связаны. Это создаст диполь в связи.
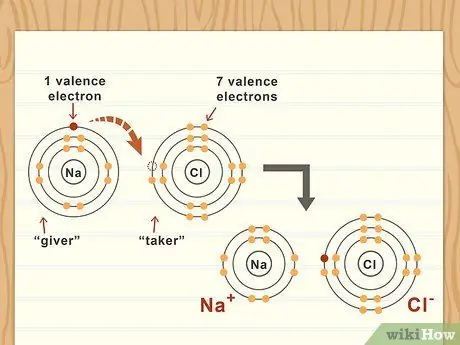
Шаг 3. Рассмотрим валентные электроны для каждого атома
Валентные электроны атома - это те, которые находятся на его внешней оболочке. По большей части атомы следуют правилу октетов, что означает, что восемь валентных электронов создадут наиболее стабильную конфигурацию. Атомы с почти восемью, вероятно, «заберут» другие электроны, в то время как атомы с одним или двумя валентными электронами, вероятно, «отдадут» свои внешние электроны.
Например, натрий (Na) имеет один валентный электрон, а хлор (Cl) - семь. Когда они связываются, они образуют соль хлорида натрия (NaCl), потому что натрий отдает свой один валентный электрон, а хлор принимает его. Это полярная связь
Метод 2 из 4: Анализ электроотрицательности
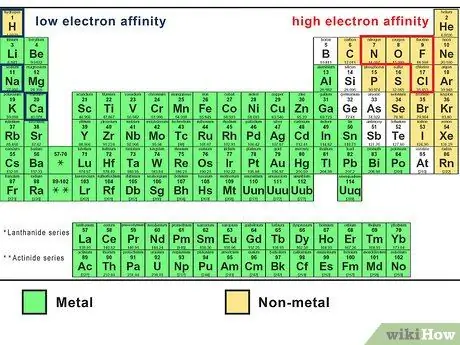
Шаг 1. Учет сродства к электрону каждого атома
Сродство атома к электрону - это мера того, насколько вероятно, что этот атом «заберет» электроны у другого атома. Сродство к электрону возрастает по мере продвижения слева направо по периодической таблице и снизу вверх. Другими словами, маленькие неметаллические атомы имеют тенденцию иметь самое высокое сродство к электрону.
- Сродство к электрону является одним из компонентов электроотрицательности атома.
- Некоторые атомы с высоким сродством к электрону - это фтор, хлор, кислород и азот.
- Несколько атомов с низким сродством - это натрий, кальций и водород.
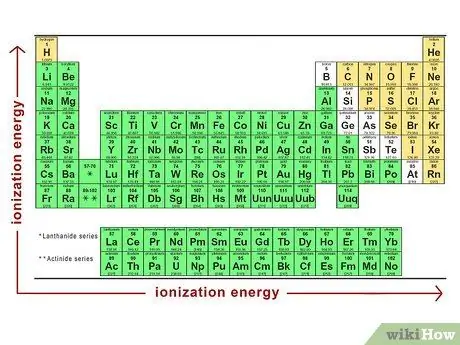
Шаг 2. Рассмотрим энергию ионизации для каждого атома
Энергия ионизации - это количество энергии, необходимое для удаления электрона из любого конкретного атома. Энергия ионизации возрастает по мере продвижения по периодической таблице слева направо и снизу вверх. Это означает, что маленькие неметаллические атомы - самые трудные для удаления электронов атомы. Легче всего подходят большие металлические атомы.
Энергия ионизации - это еще один компонент электроотрицательности атома. Это противоположность сродства к электрону, поскольку оно указывает количество энергии, необходимое для удаления электрона из атома
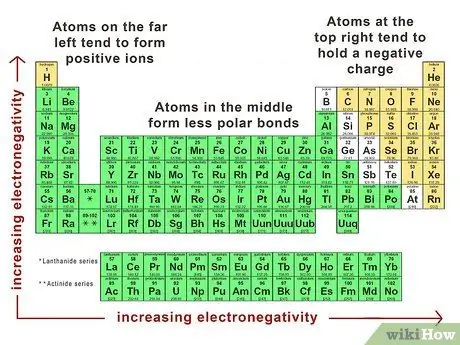
Шаг 3. Используйте тренды периодической таблицы
Глядя на таблицу Менделеева, вы можете многое сказать о том, насколько полярной будет связь между любыми двумя атомами. Атомы в правом верхнем углу таблицы, такие как хлор и кислород, будут ионизироваться и удерживать отрицательный заряд. Атомы в крайнем левом углу таблицы, такие как водород и натрий, имеют тенденцию образовывать положительные ионы. Атомы в середине таблицы образуют менее полярные связи.
Метод 3 из 4: классификация типов облигаций
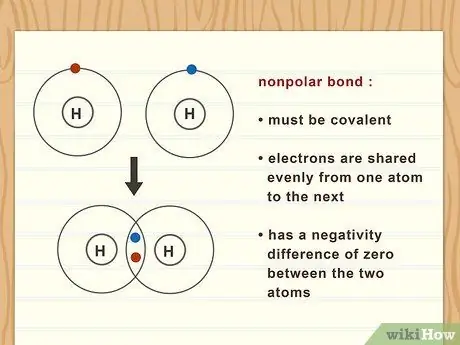
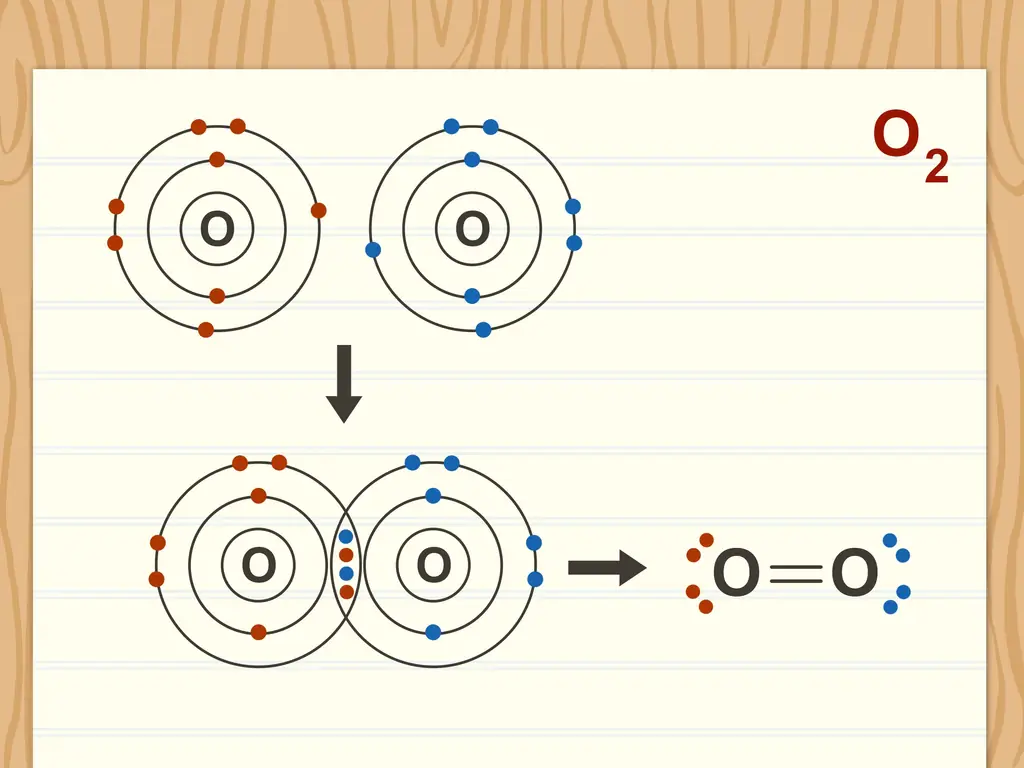
Шаг 1. Считайте все неполярные связи ковалентными
По определению неполярная связь должна быть ковалентной. Это означает, что электроны равномерно распределяются от одного атома к другому. Действительно неполярная связь имеет нулевую отрицательную разницу между двумя атомами.
Например, газообразный водород (H2) образует неполярную связь между двумя атомами водорода, потому что они имеют одинаковую электроотрицательность.
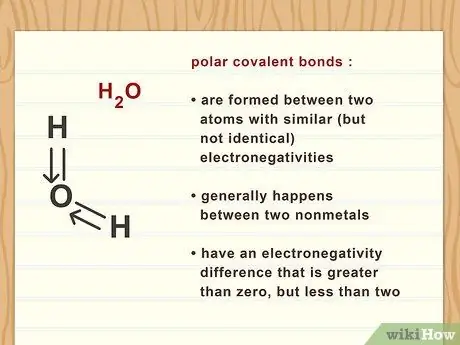
Шаг 2. Распознайте полярные ковалентные связи
Полярные ковалентные связи образуются, когда у вас есть два атома с одинаковыми (но не идентичными) электроотрицательностями. Обычно это происходит между двумя неметаллами и имеет слабый диполь. Эти связи имеют разность электроотрицательностей больше нуля, но меньше двух.
Например, связь углерод-водород слабо полярна, что делает ее полярной ковалентной связью. Поскольку углерод (2,55) немного более электроотрицателен, чем водород (2,2), он лишь немного больше притягивает общий электрон. Однако разница в электроотрицательности между этими двумя атомами составляет 0,35, что делает связь слабой
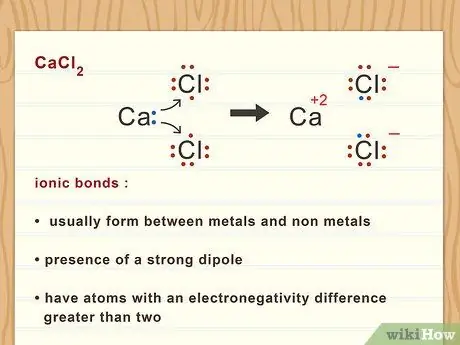
Шаг 3. Классифицируйте ионные связи
Ионные связи обычно образуются между металлами и неметаллами. Когда каждый атом ионизируется до аниона или катиона, возникает сильный диполь. Ионные связи имеют атомы с разницей электроотрицательностей больше двух.
Связи между кальцием и хлором ионные. Это связано с тем, что кальций имеет тенденцию терять 2 своих внешних валентных электрона, образуя положительный ион. Хлор имеет тенденцию собирать электроны, образуя отрицательный ион. Затем эти два противоположно заряженных иона образуют электростатическую связь, образуя CaCl2
Метод 4 из 4: решение практических задач

Шаг 1. Определите полярность поваренной соли
Поваренная соль имеет химическую формулу NaCl, так как она состоит из одного атома натрия и одного атома хлора. Чтобы определить полярность поваренной соли, вы можете найти, что электроотрицательность натрия составляет 0,9, а хлора - 3,0. Вы обнаружите, что разница между двумя электроотрицательностями составляет 2,1, что означает, что поваренная соль удерживается вместе ионной связью (и, следовательно, является полярной).
Вы также можете сделать разумное предположение, что связь полярная, просто заметив, где каждый атом находится в периодической таблице

Шаг 2. Найдите разницу в электроотрицательности углерода и водорода
Начните с просмотра таблицы Менделеева, в которой перечислены значения электроотрицательности. Вы обнаружите, что водород равен 2,1, а углерод - 2,5. Разница между ними составляет 0,4, что означает, что связь углерод-водород (слегка) полярна.
Шаг 3. Приведите пример действительно неполярной связи между двумя разными атомами
Чтобы добиться этого, вы должны взглянуть на периодическую таблицу, в которой перечислены электроотрицательности. Найдите два атома с одинаковой электроотрицательностью. Эти два атома образуют ковалентную связь.