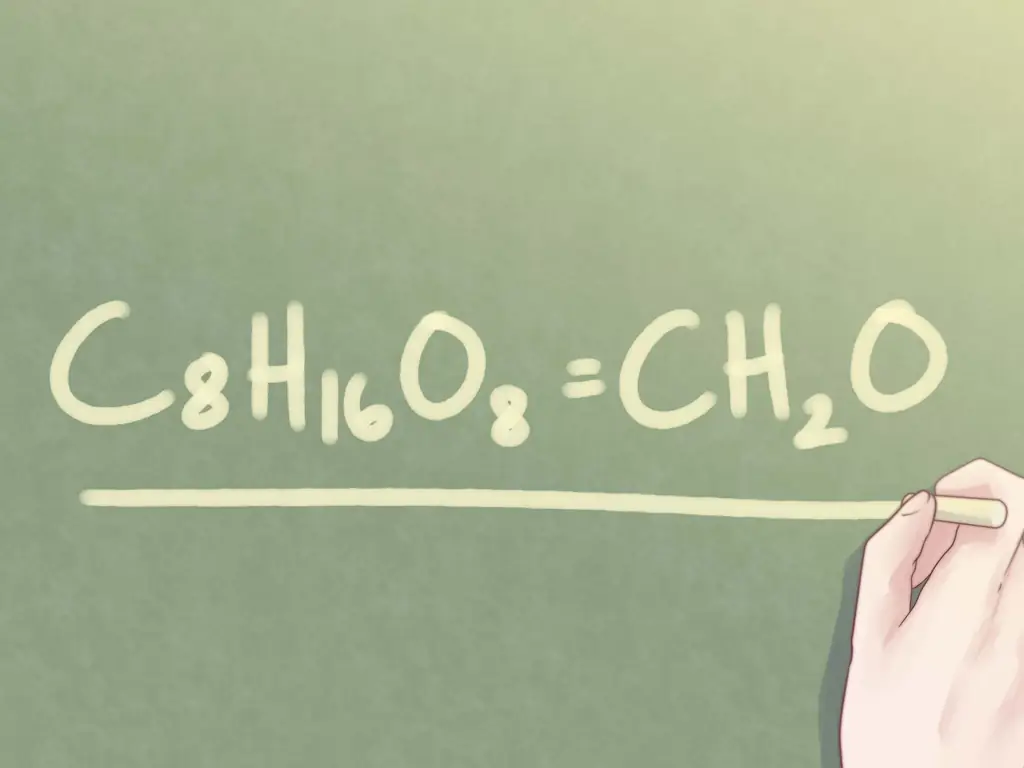Эмпирическая формула соединения - это простейшее письменное выражение его элементного состава. Вы должны быть в состоянии определить эмпирическую формулу для любого соединения, если вы знаете массу каждого присутствующего элемента, процент массы для каждого присутствующего элемента или молекулярную формулу соединения.
Шаги
Метод 1 из 3: Метод первый: использование весовых процентов
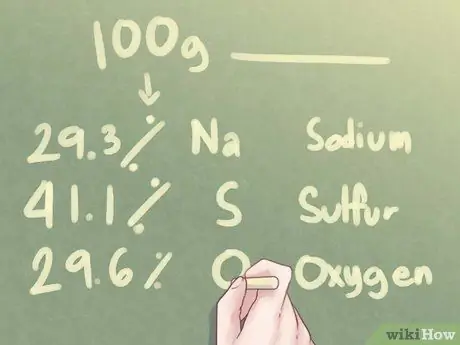
Шаг 1. Посмотрите данные
Если вам дан элементный состав неизвестного соединения в процентах, а не в граммах, вы должны предположить, что имеется ровно 100,0 граммов этого вещества.
- Это инструкции, которым вы должны следовать, если все вышесказанное верно. Если вам дан элементный состав неизвестного вещества в граммах, см. Раздел «Использование веса в граммах».
-
Пример:
Определите эмпирическую формулу соединения, состоящего из 29,3% Na (натрия), 41,1% S (серы) и 29,6% O (кислорода).
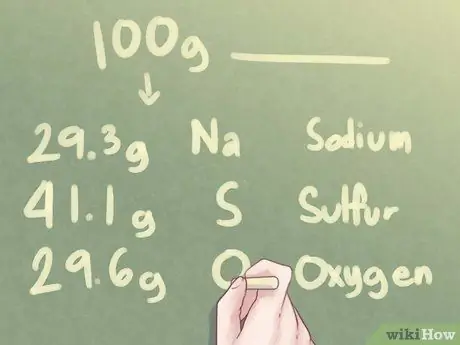
Шаг 2. Определите количество граммов для каждого элемента
Исходя из предположения, что существует 100 граммов неизвестного вещества, вы можете определить, что количество граммов каждого элемента равно процентному значению каждого элемента, упомянутого в задаче.
-
Пример:
На 100 г неизвестного вещества приходится 29,3 г Na, 41,1 г S и 29,6 г O.
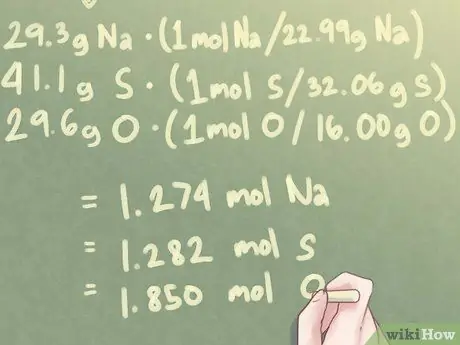
Шаг 3. Преобразуйте массу каждого элемента в моль
Массу каждого элемента в вашем составе, выражаемую в настоящее время в граммах, нужно будет преобразовать в моли. Для этого каждая масса должна быть умножена на мольное отношение к их соответствующим атомным весам.
- Проще говоря, вам нужно будет разделить каждую массу на атомный вес этого элемента.
- Также обратите внимание, что атомные веса, используемые в этом расчете, должны включать не менее четырех значащих цифр.
-
Пример:
Для соединения с 29,3 г Na, 41,1 г S и 29,6 г O:
- 29,3 г Na * (1 моль S / 22,99 г Na) = 1,274 моль Na
- 41,1 г S * (1 моль S / 32,06 г S) = 1,282 моль S
- 29,6 г O * (1 моль O / 16,00 г O) = 1,850 моль O
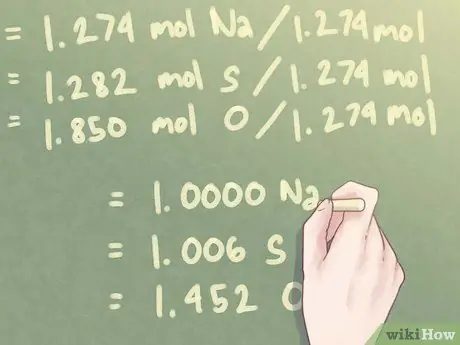
Шаг 4. Разделите каждое значение молей на наименьшее количество присутствующих молей
Вам понадобится стехиометрическое сравнение между элементами в вашем соединении, что по сути означает, что вам нужно рассчитать, сколько элемента у вас есть по сравнению с другими элементами, присутствующими в вашем соединении. Для этого разделите каждое количество родинок на наименьшее количество имеющихся родинок.
-
Пример:
Наименьшее количество молей, присутствующих в соединении, составляет 1,274 молей (количество молей для Na, натрия).
- 1,274 моль Na / 1,274 моль = 1,000 Na
- 1,282 моль S / 1,274 моль = 1,006 S
- 1,850 моль O / 1,274 моль = 1,452 O
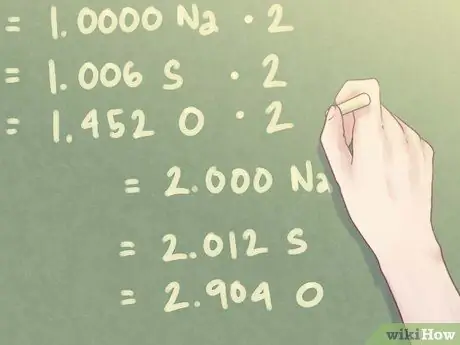
Шаг 5. Умножьте значения отношения, чтобы найти почти целые числа
Количество молей, присутствующих для каждого элемента, может не равняться целым числам. Для небольших значений, которые находятся в пределах одной десятой от целого числа, это не представляет проблемы. Однако, если у вас есть избыточное значение, превышающее это количество, вам следует умножить значения отношения по мере необходимости, чтобы довести это значение до целого числа.
- Если один элемент имеет значение около 0,5, умножьте каждый элемент на 2. Аналогичным образом, если один элемент имеет значение около 0,25, умножьте каждый элемент на 4.
-
Пример:
Поскольку количество присутствующего кислорода (O) близко к 1,5, вам нужно будет умножить каждое значение на «2», чтобы приблизить отношение кислорода к целому числу.
- 1.000 Na * 2 = 2.000 Na
- 1,006 S * 2 = 2,012 S
- 1,452 O * 2 = 2,904 O
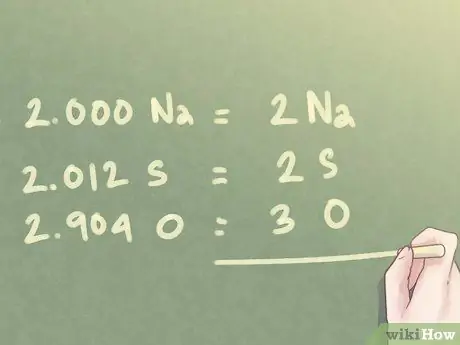
Шаг 6. Округлите значения до ближайшего целого числа
Даже после последнего шага количество присутствующих молей для каждого элемента может быть не точным целым числом. Поскольку в эмпирических формулах десятичные дроби не используются, вам необходимо округлить каждое значение до ближайшего целого числа.
-
Пример:
Для соотношения, определенного на предыдущем шаге:
- 2.000 Na можно записать как 2 Na.
- 2.012 S можно округлить до 2 S.
- 2.904 O может быть округлено до 3 O.
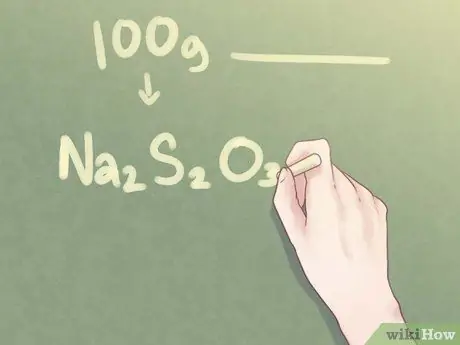
Шаг 7. Напишите свой окончательный ответ
Переведите соотношение элементов в стандартный формат, используемый для эмпирической формулы. Молекулярное количество каждого элемента должно быть указано в нижнем индексе рядом с символом соответствующего элемента для всех количеств, превышающих единицу.
-
Пример:
Для соединения, состоящего из 2 частей Na, 2 частей S и 3 частей O, эмпирическая формула должна быть записана как: Na2S2О3
Метод 2 из 3: Метод второй: использование веса в граммах
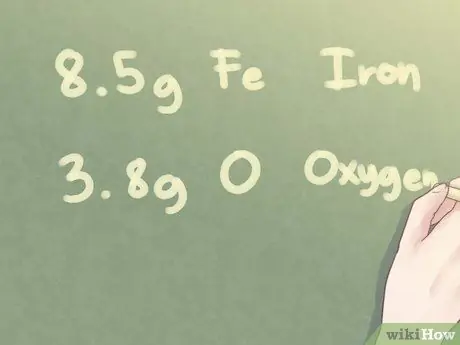
Шаг 1. Считайте количество граммов
Если вам дан элементный состав неизвестного вещества в граммах, вам нужно будет действовать в соответствии со следующими инструкциями.
- С другой стороны, если вам дан состав в процентах, а не в граммах, см. Инструкции в разделе «Использование весовых процентов».
-
Пример:
Определите эмпирическую формулу неизвестного вещества, состоящего из 8,5 г Fe (железо) и 3,8 г O (кислорода).
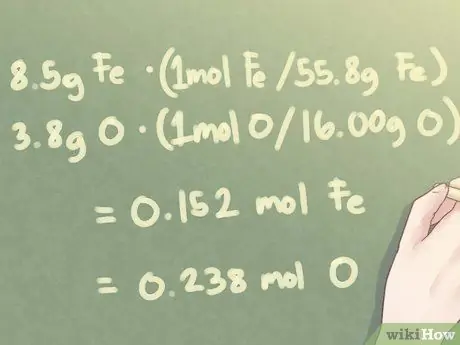
Шаг 2. Преобразуйте массу каждого элемента в моль
Чтобы определить молекулярное соотношение элементов в соединении, вам необходимо перевести количество каждого элемента из граммов в моль. Сделайте это, разделив массу в граммах каждого элемента на соответствующие атомные веса элементов.
- С технической точки зрения, вы фактически умножаете массу в граммах на мольное соотношение на атомный вес.
- Обратите внимание, что атомный вес следует округлить до четырех значащих цифр, чтобы обеспечить определенную точность вычислений.
-
Пример:
Когда имеется 8,5 г Fe и 3,8 г O:
- 8,5 г Fe * (1 моль Fe / 55,85 г Fe) = 0,152 моль Fe
- 3,8 г O * (1 моль O / 16,00 г O) = 0,238 моль O
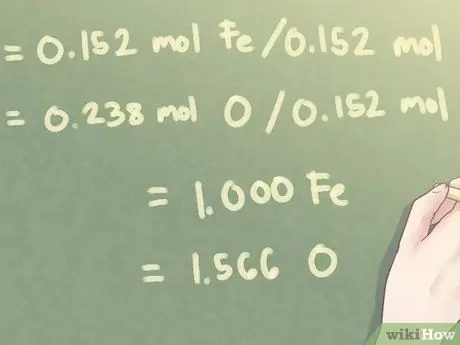
Шаг 3. Разделите каждое значение моля на наименьшее рассчитанное число
Определите, сколько каждого элемента присутствует по сравнению с другими элементами в соединении. Чтобы рассчитать это, вам нужно будет определить наименьшее количество присутствующих родинок и разделить каждое количество родинок на это число.
-
Пример:
Для этой задачи наименьшее количество присутствующих молей составляет 0,152 молей (количество Fe, железа, присутствующего).
- 0,152 моль Fe / 0,152 моль = 1.000 Fe
- 0,238 моль O / 0,152 моль = 1,566 O
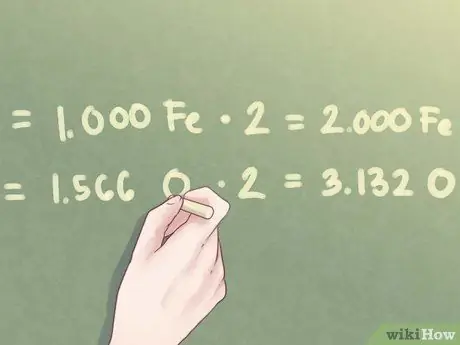
Шаг 4. Умножьте значения отношения, чтобы найти почти целые числа
Часто количество родинок каждого вещества может не равняться целому числу. Если превышение находится в пределах одной десятой, вы можете просто округлить его. Однако для дополнительных значений, которые превышают это, вам нужно будет умножить каждое значение на число, которое может приблизить значение отношения к целому числу.
- Например, если один элемент имеет избыток около 0,25, умножьте количество каждого элемента на 4. Если элемент имеет избыток около 0,5, умножьте количество каждого элемента на 2.
-
Пример:
Поскольку соотношение количества кислорода равно 1,566, вам нужно будет умножить оба значения отношения на 2.
- 1.000 Fe * 2 = 2.000 Fe
- 1,566 O * 2 = 3,132 O

Шаг 5. Округлите ответ до ближайшего целого числа
Как только значения соотношений всех элементов в соединении будут примерно в пределах одной десятой целого числа, вы можете округлить любую разницу до ближайшего целого числа.
-
Пример:
Количество Fe можно записать как 2. Количество O можно округлить до 3.
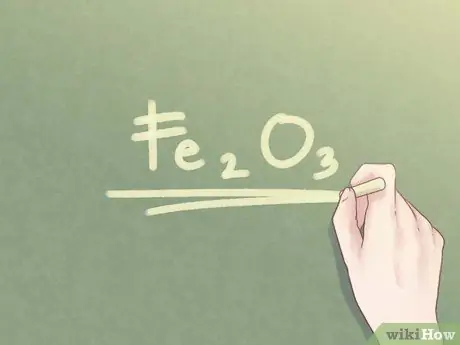
Шаг 6. Напишите окончательный ответ
Соотношение элементов следует переписать в виде эмпирической формулы. Каждое значение отношения должно быть указано в нижнем индексе рядом с символом соответствующего элемента, если значение отношения не равно единице.
-
Пример:
Для соединения, состоящего из 2 частей Fe и 3 частей O, эмпирическая формула: Fe2О3
Метод 3 из 3: Метод третий: Использование молекулярной формулы
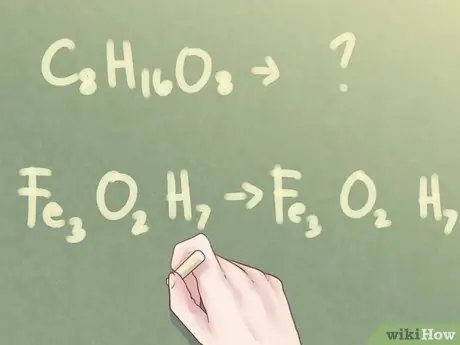
Шаг 1. Определите, можно ли уменьшить индексы
Если у вас есть молекулярная формула неизвестного соединения, но вам предлагается идентифицировать соединение по его эмпирической формуле, вам необходимо определить, можно ли сократить формулу. Посмотрите на индексы для каждого присутствующего элемента. Если все три нижних индекса имеют хотя бы один общий фактор (отличный от числа 1), вам нужно будет предпринять еще несколько шагов, чтобы определить эмпирическую формулу соединения.
-
Пример:
C8ЧАС16О8
-
С другой стороны, если не все индексы имеют общий фактор, молекулярная формула также является эмпирической формулой.
Пример: Fe3О2ЧАС7

Шаг 2. Найдите наибольший общий делитель индексов
Напишите множители каждого нижнего индекса в вашей формуле. Определите, какой фактор имеет наибольшее значение.
-
Пример:
Для C8ЧАС16О8, нижние индексы - «16» и «8».
- Множители 8: 1, 2, 4, 8.
- Множители 16: 1, 2, 4, 8, 16.
- Наибольший общий множитель (GCF) между двумя числами равен 8.

Шаг 3. Разделите каждый нижний индекс на наибольший общий множитель
Чтобы получить каждый нижний индекс в его простейшей форме, вам нужно будет разделить все нижние индексы, присутствующие в формуле, на только что найденный GCF.
-
Пример:
Для C8ЧАС16О8:
- Разделите нижний индекс 8 на GCF 8: 8/8 = 1.
- Разделите нижний индекс 16 на GCF 8: 16/8 = 2.
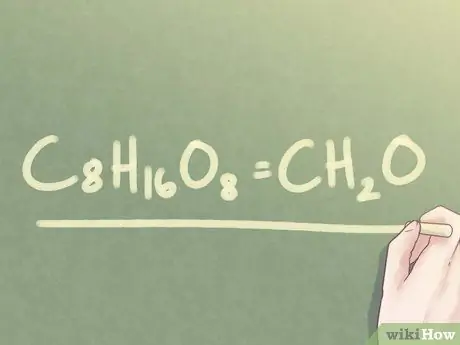
Шаг 4. Напишите окончательный ответ
Замените исходные индексы их упрощенными значениями. При этом вы определили эмпирическую формулу соединения по его молекулярной формуле.
- Обратите внимание, что значения 1 обычно не указываются индексами.
-
Пример:
C8ЧАС16О8 = CH2О