Плотность определяется как количество массы, присутствующей в данном объеме. Для твердых тел и жидкостей это довольно простое измерение. Однако газы чрезвычайно чувствительны к температуре и давлению (в большей степени, чем твердые вещества или жидкости), что может привести к довольно быстрому изменению их плотности. Если вы определяете плотность экспериментальным путем, вам придется учитывать эту чувствительность к температуре и давлению. Если вы намереваетесь найти теоретическую плотность газа, вам нужно будет использовать Закон идеального газа для учета всех переменных.
Шаги
Метод 1 из 3: экспериментальное определение плотности газа

Шаг 1. Наполните воздушный шарик
Воздушный шар предназначен для надувания газом, что делает его идеальным сосудом для хранения фиксированного количества газа. Вы можете наполнить воздушный шар воздухом с помощью насоса или выбрать другой тип газа, например гелий или азот. Как только баллон наполнится, завяжите его конец, чтобы не выходил газ.

Шаг 2. Полностью погрузите баллон в прозрачный контейнер
Затем погрузите воздушный шар в емкость с водой. Воздушный шар поднимет уровень воды. Отметьте новую высоту воды и снимите баллон.

Шаг 3. Измерьте количество вытесненной воды
Используйте измерительный инструмент (например, чашку или химический стакан), чтобы измерить количество воды, необходимое для наполнения емкости до отметки (без баллона в воде). Поливайте медленно. Если вы нальете слишком много, придется начинать заново. Объем воздушного шара равен объему добавленной вами воды. Запишите это значение для дальнейшего использования как V.
Вы можете сэкономить время, погрузив баллон в большой стакан или другой предварительно отмеренный контейнер. Затем вы можете пропустить добавление воды и просто вычтите объем воды из объема воды и воздушного шара

Шаг 4. Взвесьте баллон, наполненный газом
Вы можете взвесить воздушный шар с помощью чувствительных весов. Электрические весы обычно лучше всего подходят для этого применения. Запишите вес газонаполненного баллона для последующего использования как m.ГБ.
Если вы наполняете баллон газом, который легче воздуха, вам нужно будет взвесить взятку до и после заполнения баллона, чтобы определить количество использованного газа

Шаг 5. Найдите массу пустого воздушного шара
Проделайте дыру в воздушном шаре. Это позволит газу уйти. Снова взвесьте баллон и запишите вес пустого баллона как m.B.
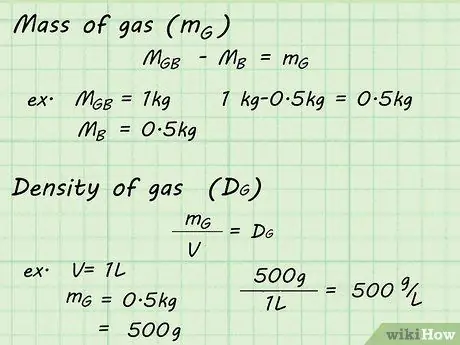
Шаг 6. Проведите расчеты
Теперь, когда у вас достаточно данных, вы можете рассчитать плотность газа внутри воздушного шара. Вычтем вес пустого аэростата, мB, от веса полного аэростата, мГБ. Это даст вам массу только газа, мграмм. Делим массу газа, мграммпо объему газа V, чтобы найти плотность газа Dграмм.
- мГБ - мB = мграмм
Например, если полный баллон имел массу 1 кг, а пустой баллон - 0,5 кг, масса газа (мграмм) можно найти по формуле: 1 кг - 0,5 кг = 0,5 кг.
- мграмм / V = Dграмм
Например, если воздушный шар вытеснил 1 л воды, плотность можно определить, разделив массу на этот объем: 500 г / 1 л = 500 г / л
Метод 2 из 3: определение теоретической плотности газа

Шаг 1. Понять закон идеального газа
Вы должны знать, что Закон идеального газа - это теоретический инструмент, который управляет поведением газов в определенных условиях. Вы можете резюмировать это в уравнении PV = nRT. Это просто означает, что давление (P), умноженное на объем (V), равно количеству молей (n), умноженному на постоянную идеального газа (R), умноженному на абсолютную температуру (T) для идеального газа.
- Моль (n) равен 6,022 * 10 ^ 23 молекул газа.
- Идеальная газовая постоянная (R) составляет 0,0821 л · атм / моль · К.
- Абсолютная температура измеряется в Кельвинах (K).

Шаг 2. Примите стандартные температуру и давление
Стандартные температура и давление, или STP, определяются как 273 K (32 ° F) (0 ° C) и 1 стандартная атмосфера (1,0 бар). Предполагая, что STP позволяет рассчитать объем 1 моля любого газа, равный 22,414 литра. Знание этого объема обязательно для определения плотности вашего газа.
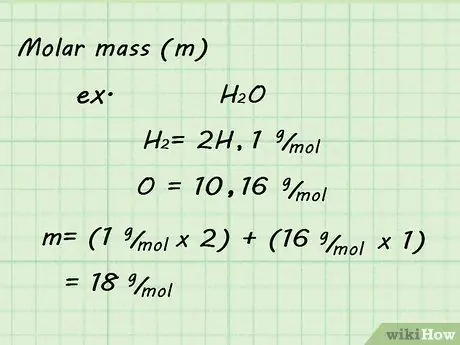
Шаг 3. Найдите молярную массу газа
Поскольку вы используете STP и принимаете один моль газа, определение молярной массы будет несложным. Сложите молярную массу всех отдельных атомов, составляющих ваш газ, чтобы найти молярную массу газа. Атомные массы можно найти в периодической таблице.
Например, определение молярной массы H2Газ O будет означать добавление масс 2 атомов водорода и 1 кислорода. Полученная молярная масса будет 18 г / моль (1 г / моль + 1 г / моль + 16 г / моль).
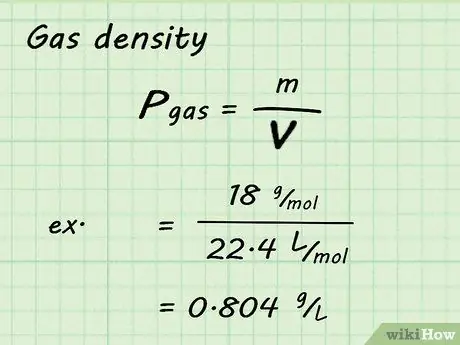
Шаг 4. Рассчитайте плотность газа
Хотя объем и моль газа в этих расчетах фиксированы, молярная масса для каждого газа разная. Это означает, что плотность также будет разной для каждого газа. Чтобы найти заданную плотность газа, разделите молярную массу газа на молярный объем (в данном случае 22,4 л / моль).
Например, если вы ищете плотность водяного пара, вы разделите 18 г / моль на 22,4 л / моль, чтобы получить 0,804 г / л. То есть: 18 г / моль / 22,4 л / моль = 0,804 г / л
Метод 3 из 3: определение теоретической плотности газовой смеси
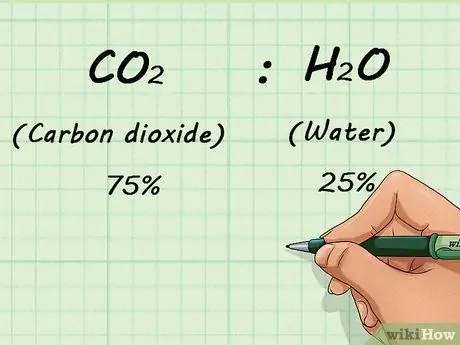
Шаг 1. Знать фракционный состав газовой смеси
Если вы смешали два или более газа, вам нужно знать, сколько каждого газа присутствует. Это делается на процентной основе. Это позволяет вам узнать соотношение смеси независимо от того, сколько всего газа присутствует.
Например, если у вас была смесь 75% CO2 (диоксид углерода) и 25% H2O (вода), эти соотношения не изменились бы, есть ли у вас 1 л или 1 000 л газа.
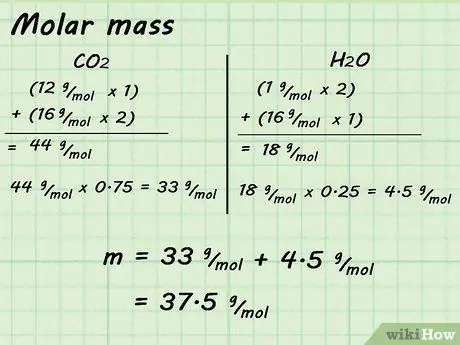
Шаг 2. Найдите массу одного крота
Зная соотношение ваших газов, вы можете найти молярную массу своей смеси. Вам нужно будет найти молярную массу каждого газа и умножить ее на процентный состав смеси. Затем сложите все продукты, чтобы определить молярную массу газовой смеси.
Например, вы найдете молярную массу CO2 (44 г / моль) и умножьте на 0,75. Затем вы найдете молярную массу H2O (18 г / моль) и умножьте его на 0,25. Когда вы складываете эти продукты вместе, 33 г / моль + 4,5 г / моль, вы получаете молярную массу вашей смеси. В этом случае молярная масса составляет 37,5 г / моль.

Шаг 3. Делить по объему
После определения молярной массы вашей смеси определение плотности газа станет простым расчетом. Разделите молярную массу на стандартный объем (22,4 л / моль). Помните, что вы принимаете STP и 1 моль газа.
- Например, плотность смеси из 75% диоксида углерода и 25% воды будет 37,5 г / моль / 22,4 л / моль = 1,67 г / л { displaystyle 37,5 г / моль / 22,4 л / моль = 1,67 г / л. }
- you must apply the ideal gas law formula for your calculations if the gas is not at stp (pv=nrt).
tips
- double check all calculations before proceeding to the next one.
- remember that the theoretical calculations make strict assumptions about the conditions of the gas.
- you need only memorize one formula: pv=nrt. you can use a variation of the same formula to find other properties. for instance, to find the volume, use v = nrt/p.
