Система может помочь в диагностике и лечении пациентов, которые не могут общаться.

Исследователи из Массачусетского технологического института и других стран разработали систему, которая измеряет уровень боли пациента, анализируя активность мозга с помощью портативного устройства нейровизуализации.
Система может помочь врачам диагностировать и лечить боль у бессознательных и некоммуникабельных пациентов, что может снизить риск хронической боли, которая может возникнуть после операции.
Управление болью - это удивительно сложное и сложное балансирование. Например, чрезмерное лечение боли может привести к привыканию пациентов к обезболивающим. С другой стороны, недостаточное лечение боли может привести к длительной хронической боли и другим осложнениям. Сегодня врачи обычно измеряют уровень боли в соответствии с собственными отчетами пациентов о том, как они себя чувствуют. Но как насчет пациентов, которые не могут эффективно или вообще не сообщать о своем самочувствии, таких как дети, пожилые пациенты с деменцией или те, кто перенес операцию?
В статье, представленной на Международной конференции по эмоциональным вычислениям и интеллектуальному взаимодействию, исследователи описывают метод количественной оценки боли у пациентов. Для этого они используют новый метод нейровизуализации, называемый функциональной ближней инфракрасной спектроскопией (fNIRS), при котором датчики, расположенные вокруг головы, измеряют концентрацию оксигенированного гемоглобина, которая указывает на активность нейронов.
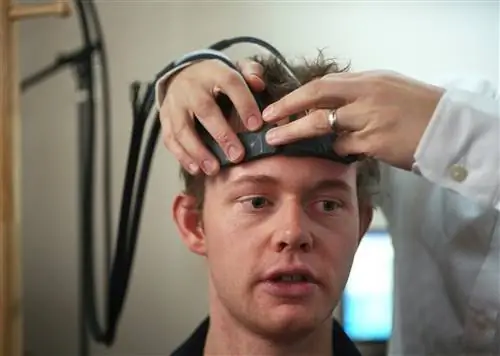
В своей работе исследователи используют всего несколько датчиков fNIRS на лбу пациента для измерения активности префронтальной коры, которая играет важную роль в обработке боли. Используя измеренные сигналы мозга, исследователи разработали персонализированные модели машинного обучения для выявления закономерностей уровней насыщенного кислородом гемоглобина, связанных с реакцией на боль. Когда датчики установлены, модели могут определить, испытывает ли пациент боль, с точностью около 87 процентов.
«Способы измерения боли с годами не изменились, - говорит Даниэль Лопес-Мартинес, аспирант программы Гарвардского Массачусетского технологического института по медицинским наукам и технологиям и исследователь в Массачусетском технологическом институте. лаборатория «Если у нас нет показателей того, насколько сильную боль кто-то испытывает, лечение боли и проведение клинических испытаний становится сложной задачей. Мотивация заключается в объективной количественной оценке боли, не требующей сотрудничества с пациентом, например, когда пациент находится без сознания во время операции».
Традиционно хирургические пациенты получают анестезию и лекарства в зависимости от их возраста, веса, предшествующих заболеваний и других факторов. Если они не двигаются и их частота сердечных сокращений остается стабильной, считается, что они в порядке. Но мозг все еще может обрабатывать болевые сигналы, пока они находятся без сознания, что может привести к усилению послеоперационной боли и длительной хронической боли. Система исследователей может предоставить хирургам информацию в режиме реального времени об уровне боли у пациента, находящегося без сознания, чтобы они могли соответствующим образом корректировать анестезию и дозировку лекарств, чтобы остановить эти болевые сигналы.
К Лопес-Мартинес в статье присоединились: Ке Пэн из Гарвардской медицинской школы, Бостонской детской больницы и Исследовательского центра CHUM в Монреале; Ариэль Ли и Дэвид Борсук, оба из Гарвардской медицинской школы, Бостонской детской больницы и Массачусетской больницы общего профиля; и Розалинда Пикард, профессор медиаискусства и науки и директор по исследованиям в области аффективных вычислений в Медиа-лаборатории.
Фокусировка на лбу
В своей работе исследователи адаптировали систему fNIRS и разработали новые методы машинного обучения, чтобы сделать систему более точной и практичной для клинического использования.
Для использования fNIRS датчики традиционно размещают вокруг головы пациента. Различные длины волн ближнего инфракрасного света проходят через череп и попадают в мозг. Оксигенированный и деоксигенированный гемоглобин по-разному поглощают длины волн, слегка изменяя свои сигналы. Когда инфракрасные сигналы отражаются обратно к датчикам, методы обработки сигналов используют измененные сигналы для расчета количества каждого типа гемоглобина, присутствующего в различных областях мозга.
Когда пациент получает травму, в областях мозга, связанных с болью, наблюдается резкое повышение содержания оксигенированного гемоглобина и снижение содержания дезоксигенированного гемоглобина, и эти изменения можно обнаружить с помощью мониторинга fNIRS. Но традиционные системы fNIRS размещают датчики вокруг головы пациента. Это может занять много времени, и это может быть сложно для пациентов, которым приходится лежать. Это также нецелесообразно для пациентов, перенесших операцию.
Поэтому исследователи адаптировали систему fNIRS специально для измерения сигналов только от префронтальной коры. В то время как обработка боли включает в себя вывод информации из нескольких областей мозга, исследования показали, что префронтальная кора интегрирует всю эту информацию. Это означает, что им нужно размещать датчики только на лбу.
Еще одна проблема с традиционными системами fNIRS заключается в том, что они улавливают некоторые сигналы от черепа и кожи, которые вносят вклад в шум. Чтобы исправить это, исследователи установили дополнительные датчики для захвата и фильтрации этих сигналов.

Новый метод нейровизуализации, называемый функциональной спектроскопией в ближней инфракрасной области (fNIRS), может помочь обнаружить боль.
Пэт Гринхаус/The Boston Globe via Getty Images
Индивидуальное моделирование боли
Что касается машинного обучения, исследователи обучили и протестировали модель на помеченном наборе данных об обработке боли, который они собрали у 43 участников мужского пола. (Далее они планируют собрать намного больше данных от различных групп пациентов, включая пациентов женского пола - как во время операции, так и в сознании, а также при различной интенсивности боли - чтобы лучше оценить точность системы.)
Каждый участник носил исследовательское устройство fNIRS и в случайном порядке подвергался безобидному ощущению, а затем около дюжины ударов током по большому пальцу при двух различных интенсивностях боли, измеряемых по шкале от 1 до 10: низкая уровень (около 3/10) или высокий уровень (около 7/10). Эти две интенсивности были определены с помощью предварительных тестов: участники сами сообщили о низком уровне как о сильном ощущении удара без боли, а о высоком уровне как о максимальной боли, которую они могли вынести..
Во время обучения модель извлекла из сигналов десятки характеристик, связанных с тем, сколько оксигенированного и деоксигенированного гемоглобина присутствовало, а также как быстро повышался уровень оксигенированного гемоглобина. Эти два показателя - количество и скорость - дают более четкое представление о том, как пациент испытывает боль различной интенсивности.
Важно, что модель также автоматически генерирует «персонализированные» подмодели, которые извлекают характеристики с высоким разрешением из отдельных подгрупп пациентов. Традиционно в машинном обучении одна модель изучает классификации - «боль» или «нет боли» - на основе средних ответов всей популяции пациентов. Но такой обобщенный подход может снизить точность, особенно для разных групп пациентов.
Модель исследователей вместо этого тренируется на всей популяции, но одновременно определяет общие характеристики среди подпопуляций в более крупном наборе данных. Например, болевые реакции на две интенсивности могут различаться у молодых и пожилых пациентов или в зависимости от пола. Это порождает выученные подмодели, которые разрываются и параллельно изучают паттерны своих подгрупп пациентов. В то же время, однако, все они по-прежнему обмениваются информацией и моделями обучения, общими для всего населения. Короче говоря, они одновременно используют детализированную персонализированную информацию и информацию на уровне населения, чтобы тренироваться лучше.
Персонализированные модели и традиционная модель оценивались при классификации боли или отсутствия боли в случайно выбранном наборе сигналов мозга участников из набора данных, где для каждого были известны оценки боли, о которых сообщали сами участники. участник. Персонализированные модели превзошли традиционную модель примерно на 20 процентов, достигнув точности около 87 процентов.
«Поскольку мы можем обнаруживать боль с такой высокой точностью, используя всего несколько датчиков на лбу, у нас есть прочная основа для применения этой технологии в реальных клинических условиях», - Лопес- Мартинес говорит.
Перепечатано с разрешения MIT News. Прочтите исходную статью.