В химической реакции материя не может быть ни создана, ни разрушена в соответствии с законом сохранения массы, поэтому продукты, возникающие в результате реакции, должны равняться реагентам, которые вступают в реакцию. Это означает, что такое же количество каждого атома, которое вы поместили, должно выйти обратно. Стехиометрия - это мера элементов в реакции. Он включает в себя расчеты, в которых учитываются массы реагентов и продуктов в данной химической реакции. Стехиометрия - это наполовину математика, наполовину химия, и она вращается вокруг одного простого принципа, приведенного выше - принципа, согласно которому материя никогда не теряется и не приобретается во время реакции. Первый шаг в решении любой химической задачи - сбалансировать уравнение.
Шаги
Часть 1 из 4: Уравновешивание химического уравнения

Шаг 1. Запишите количество атомов, составляющих каждое соединение по обе стороны уравнения
Используя химическое уравнение, вы можете определить атомы каждого элемента в реакции. Поскольку химическая реакция никогда не может создать или разрушить новую материю, данное уравнение неуравновешивается, если количество (и типы) атомов на каждой стороне уравнения не полностью совпадают.
- Не забудьте умножить на коэффициент или нижний индекс, если он есть.
- Например, H2ТАК4 + Fe - Fe2(ТАК4)3 + H2
- На стороне реагента (слева) уравнения находятся 2 атома H (H2), 1 атом S, 4 атома O (O4) и 1 атом Fe.
- В произведении (правой) части уравнения находятся 2H-атомы (H2), 3 атома S (S3), 12 атомов O (O 12) и 2 атома Fe (Fe2).
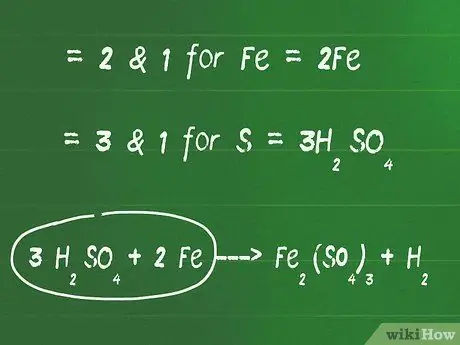
Шаг 2. Добавьте коэффициент перед элементами, не являющимися кислородом и водородом, чтобы сбалансировать каждую сторону
Определите наименьший общий множитель между всеми элементами, не являющимися кислородом и водородом (далее вы сбалансируете их), чтобы получить равное количество атомов с обеих сторон.
- Например, наименьший общий множитель между 2 и 1 для Fe равен 2. Добавьте 2 перед Fe с левой стороны, чтобы сбалансировать его.
- Наименьший общий множитель между 3 и 1 равен 3 для S. Добавьте 3 перед H.2ТАК4 чтобы сбалансировать левую и правую стороны.
- На данном этапе наше уравнение выглядит так: 3 H2ТАК4 + 2 Fe - Fe2(ТАК4)3 + H2
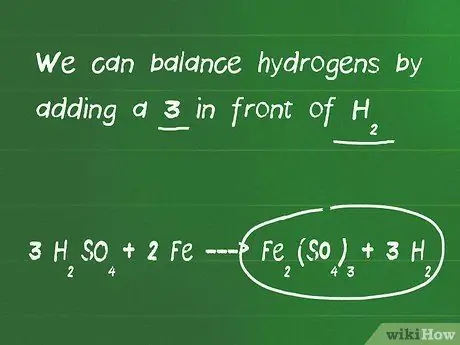
Шаг 3. Сбалансируйте атомы водорода и кислорода
Атомы водорода и кислорода уравновешиваются последними, потому что они обычно появляются в нескольких молекулах с каждой стороны уравнения. На этом этапе уравновешивания уравнения не забудьте пересчитать атомы, если вы добавили коэффициенты к молекулам.
- В нашем примере мы добавили 3 перед H2ТАК4 и теперь 6 атомов водорода находятся в левой и только 2 в правой части уравнения. У нас также есть 12 кислорода слева и 12 кислорода справа, так что это сбалансировано.
- Мы можем сбалансировать водород, добавив 3 перед H2.
- Наше окончательное сбалансированное уравнение - 3 H2ТАК4 + 2 Fe - Fe2(ТАК4)3 + 3 часа2.

Шаг 4. Пересчитайте количество атомов с каждой стороны уравнения, чтобы убедиться, что они равны
Как только вы закончите, разумно вернуться и проверить уравнение на баланс. Это можно сделать, снова сложив все атомы по обе стороны уравнения, чтобы убедиться, что они равны с обеих сторон.
- Давайте проверим наше уравнение, 3 H2ТАК4 + 2 Fe - Fe2(ТАК4)3 + 3 часа2, для баланса.
- Слева от стрелки расположены 6 H, 3 S, 12 O и 2 Fe.
- Справа от стрелки расположены 2 Fe, 3 S, 12 O и 6 H.
- Левая и правая части уравнения совпадают, поэтому теперь оно сбалансировано.
Часть 2 из 4: Преобразование граммов в моль
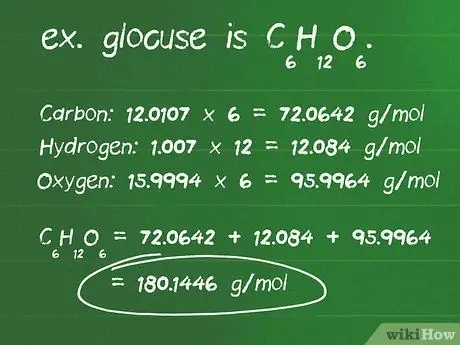
Шаг 1. Рассчитайте молярную массу соединения в граммах
Молярная масса - это количество в граммах (г) одного моля соединения. Он позволяет легко переводить граммы в моль вещества. Чтобы вычислить молярную массу, вам необходимо определить, сколько молекул элемента находится в соединении, и атомную массу каждого элемента в соединении.
- Определите количество атомов каждого элемента в соединении. Например, глюкоза - это C6ЧАС12О6, есть 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода.
- Определите атомную массу в граммах на моль (г / моль) каждого атома. Атомные массы каждого элемента обычно находятся под символом элемента в периодической таблице, обычно в виде десятичной дроби. Атомные массы элементов в глюкозе составляют: углерод 12,0 · 107 г / моль; водород 1,007 г / моль; и кислород 15,9994 г / моль.
- Умножьте атомную массу каждого элемента на количество атомов, присутствующих в соединении. Углерод: 12,0107 х 6 = 72,0642 г / моль; Водород: 1,007 х 12 = 12,084 г / моль; Кислород: 15,9994 x 6 = 95,9964 г / моль.
- Добавление этих продуктов вместе дает молярную массу соединения. 72,0642 + 12,084 + 95,9964 = 180,1446 г / моль. 180,14 грамма - это масса одного моля глюкозы.
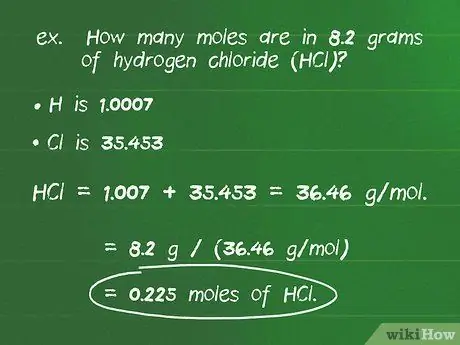
Шаг 2. Перевести граммы вещества в моль, используя молярную массу
Используя молярную массу в качестве коэффициента преобразования, вы можете рассчитать количество молей, присутствующих в заявленном количестве граммов вещества. Разделите известное количество в граммах (г) на молярную массу (г / моль). Самый простой способ проверить, что вы выполнили правильные вычисления, - убедиться, что единицы уравновешивают, оставляя только родинки.
- Например: сколько молей содержится в 8,2 граммах хлористого водорода (HCl)?
- Атомная масса H составляет 1,007, а Cl составляет 35,453, что составляет молярную массу соединения 1,007 + 35,453 = 36,46 г / моль.
- Разделив количество граммов вещества на молярную массу, получим: 8,2 г / (36,46 г / моль) = 0,225 моль HCl.

Шаг 3. Определите молярное соотношение между реагентами
Чтобы определить выход продукта в данной реакции, вам необходимо определить молярное соотношение. Молярное соотношение сообщает вам соотношение, в котором вещества реагируют друг с другом, и выражается коэффициентом частиц в сбалансированной реакции.
- Например, каково мольное соотношение KClO3 тоже2 в реакции 2 KClO3 - 2 KCl + 3 O2.
- Сначала проверьте, сбалансировано ли уравнение. Никогда не забывайте этот шаг, иначе ваши соотношения будут неправильными. В этом случае по обе стороны от реакции присутствует равное количество каждого элемента, поэтому она уравновешена.
- Соотношение KClO3 тоже2 составляет 2/3. Неважно, какое число идет вверху или внизу, если вы сохраняете одни и те же соединения вверху и внизу на протяжении всей остальной части задачи.

Шаг 4. Умножьте на молярное соотношение, чтобы найти моль другого реагента
Чтобы рассчитать количество молей, образующихся или необходимых для реакции, вы воспользуетесь молярным соотношением. Задачи обычно просят вас определить необходимое количество молей или количество молей, образующихся в реакции, с учетом определенного количества граммов реагента.
- Например, учитывая реакцию N2 + 3 часа2 - 2 NH3 сколько молей NH3 будет произведено с учетом 3,00 граммов N2 реагируя с достаточным количеством H2?
- В этом примере достаточно H2 означает, что их достаточно, и вам не нужно учитывать это для решения проблемы.
- Сначала преобразуйте граммы N2 к родинкам. Атомная масса азота составляет 14,0067 г / моль, поэтому молярная масса N2 составляет 28,0134 г / моль. Разделив массу на молярную, получим 3,00 г / 28,0134 г / моль = 0,107 моль.
- Установите коэффициенты, указанные в вопросе: NH3: N2 = х / 0,107 моль.
- Умножьте это соотношение крест-накрест на молярное соотношение NH3 к N2: 2: 1. x / 0,107 моль = 2/1 = (2 x 0,107) = 1x = 0,214 моль.

Шаг 5. Преобразуйте количество молей обратно в массу, используя молярную массу вида
Вы снова будете использовать молярную массу, но на этот раз умножьте, чтобы преобразовать моли обратно в граммы. Обязательно используйте молярную массу правильного вида.
Молярная масса NH3 составляет 17,028 г / моль. Следовательно, 0,214 моль x (17,028 г / моль) = 3,647 г NH.3.
Часть 3 из 4: Преобразование литров газа в моли

Шаг 1. Определите, происходит ли реакция при стандартной температуре и давлении (STP)
STP - это набор условий, при которых 1 моль идеального газа занимает 22,414 литра (л) объема. Стандартная температура составляет 273,15 кельвина (К), а стандартное давление - 1 атмосфера (атм).
Как правило, в реакции говорится, что он дается при 1 атм и 273 К, или просто STP
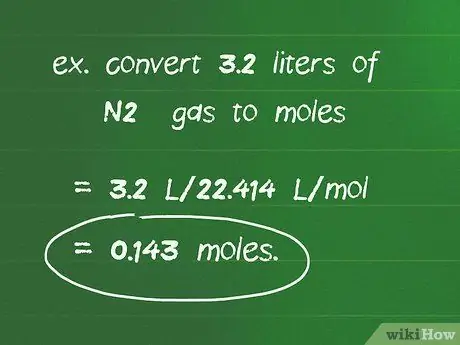
Шаг 2. Используйте коэффициент преобразования 22,414 л / моль для перевода литров газа в моль
Если ваша реакция происходит в STP, вы можете использовать 22,414 л / моль для расчета количества молей в заданном объеме газа. Разделите объем газа (л) на коэффициент пересчета, чтобы определить количество молей.
Например, преобразовать 3,2 литра N2 газ в моль: 3,2 л / 22,414 л / моль = 0,143 моль.

Шаг 3. Используйте закон идеального газа для преобразования литров газа не на STP
Если вам дана реакция, которая не происходит в STP, вам придется использовать закон идеального газа PV = nRT, чтобы определить количество молей в реакции. P - давление в атмосферах, V - объем в литрах, n - количество молей, R - постоянная газового закона 0,0821 л-атм / моль-градус, а T - температура в градусах Кельвина.
- Уравнение можно переформулировать для решения молей: n = RT / PV.
- Единицы газовой постоянной предназначены для исключения единиц других переменных.
- Например, определите количество молей в 2,4 л O2 при 300 К и 1,5 атм. Подстановка переменных дает: n = (0,0821 x 300) / (1,5 x 2) = 24,63 / 3,6 = 6,842 моль O2
Часть 4 из 4: преобразование литров жидкости в моли
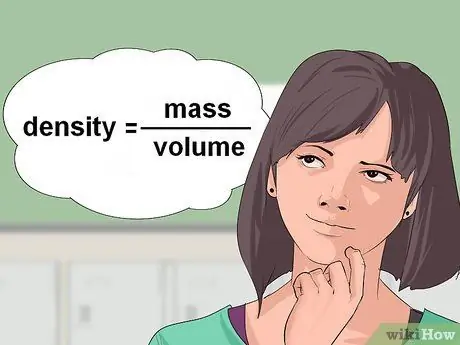
Шаг 1. Рассчитайте плотность жидкости
Иногда химические уравнения дают вам объем жидкого реагента и требуют количества граммов или молей, необходимого для реакции. Чтобы преобразовать в граммы, вы будете использовать плотность этой жидкости. Плотность выражается как масса / объем.
Если плотность в задаче не указана, возможно, вам придется поискать ее в справочном тексте или в Интернете

Шаг 2. Преобразуйте объем в миллилитры (мл)
Чтобы преобразовать объем жидкости в массу (г), вам нужно будет использовать плотность этой жидкости. Плотность указывается в граммах на миллилитр (г / мл), поэтому для преобразования объем жидкости должен быть в миллилитрах.
Определите данный объем. Например, предположим, что проблема заключается в том, что у вас есть 1 литр H2О. Чтобы перевести в миллилитры, просто умножьте на 1000. В литре воды 1000 миллилитров.

Шаг 3. Умножьте объем на плотность
Когда вы умножаете объем (мл) на плотность этой жидкости (г / мл), миллилитры сокращаются, и у вас остаются граммы вещества.
Плотность H2O, например, составляет приблизительно 1,0 г / мл.
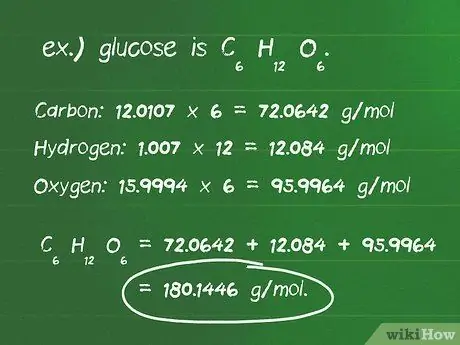
Шаг 4. Рассчитайте молярную массу реагента
Молярная масса - это количество в граммах (г) одного моля соединения. Он позволяет легко переводить граммы в моль вещества. Чтобы вычислить молярную массу, вам нужно определить, сколько молекул элемента входит в состав соединения, и атомную массу каждого элемента в соединении.
- Определите количество атомов каждого элемента в соединении. Например, глюкоза - это C6ЧАС12О6, есть 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода.
- Определите атомную массу в граммах на моль (г / моль) каждого атома. Атомные массы элементов в глюкозе составляют: углерод 12,0 · 107 г / моль; водород 1,007 г / моль; и кислород 15,9994 г / моль.
- Умножьте атомную массу каждого элемента на количество атомов, присутствующих в соединении. Углерод: 12,0107 х 6 = 72,0642 г / моль; Водород: 1,007 х 12 = 12,084 г / моль; Кислород: 15,9994 x 6 = 95,9964 г / моль.
- Добавление этих продуктов вместе дает молярную массу соединения. 72,0642 + 12,084 + 95,9964 = 180,1446 г / моль. 180,14 грамма - это масса одного моля глюкозы.

Шаг 5. Переведите граммы вещества в моль, используя молярную массу
Используя молярную массу в качестве коэффициента преобразования, вы можете рассчитать количество молей, присутствующих в заявленном количестве граммов вещества. Разделите известное количество в граммах (г) на молярную массу (г / моль). Самый простой способ проверить, что вы выполнили правильные вычисления, - убедиться, что единицы уравновешивают, оставляя только родинки.
- Например: сколько молей содержится в 8,2 граммах хлористого водорода (HCl)?
- Атомная масса H составляет 1,007, а Cl составляет 35,453, что составляет молярную массу соединения 1,007 + 35,453 = 36,46 г / моль.
- Разделив количество граммов вещества на молярную массу, получим: 8,2 г / (36,46 г / моль) = 0,225 моль HCl.
