Эксперимент со скрипучей попкой - это типичный метод научной лаборатории, используемый для проверки наличия водорода, который не имеет цвета и запаха. Когда водород находится в ловушке в контейнере, вы можете поднести к нему зажженную спичку, и она издаст характерный «скрипучий хлопок», когда реагирует с пламенем. Если вам когда-нибудь понадобится проверить наличие газообразного водорода, это простой (и увлекательный) метод.
Шаги
Часть 1 из 3: Создание водородного газа

Шаг 1. Соберите необходимые материалы
Для создания газообразного водорода вам потребуются соляная кислота, полоски магния, пробирка, спичка, лабораторные перчатки и защита для глаз. Когда вы помещаете металл в соляную кислоту, он реагирует с образованием газообразного водорода и соединения хлорида металла.
- Вам нужно всего около 20 мл разбавленной соляной кислоты (около 2 молярных).
- Полоски магния можно приобрести в Интернете.
- Безопасность важна, поэтому обязательно используйте перчатки и защиту для глаз на протяжении всего эксперимента.
- Для проведения этого эксперимента требуется наблюдение взрослых.
Шаг 2. Создайте подходящую среду
В идеале этот эксперимент будет проводиться в химической лаборатории. Средства обеспечения безопасности, такие как огнетушитель, установка для промывания глаз и душ, должны быть легко доступны. Помещение также должно быть открытым и хорошо проветриваемым.
Не проводите этот эксперимент самостоятельно в своей спальне. Убедитесь, что под присмотром находится взрослый

Шаг 3. Добавьте соляную кислоту в пробирку
Надев перчатки и защитные очки, налейте в пробирку около 20 миллилитров (0,7 жидких унций) соляной кислоты. Вам не нужно ровно 20 миллилитров (0,68 жидких унций), но налейте ровно столько соляной кислоты, пока на дне пробирки не останется около 2 сантиметров (0,79 дюйма).
- Если вы разбавляете кислоту, всегда добавляйте кислоту прямо в воду. Если добавить наоборот, кислота может взорваться и нанести травму.
- Обратите внимание, что соляная кислота вызывает коррозию и выделяет кислотный туман.

Шаг 4. Добавьте в пробирку полоску магния
Опустите полоску магния в пробирку с соляной кислотой. Раствор должен начать пузыриться, как только металл войдет в контакт с жидкостью. Эти пузыри - газообразный водород.
Вы можете добавить более 1 полоски, чтобы ускорить образование водорода

Шаг 5. Надежно накройте трубку пластиком
Оберните верхнюю часть пробирки полиэтиленовой пленкой сразу после добавления металла. Резинкой закрепите пластик на месте, чтобы как можно плотнее закрыть трубку, чтобы газообразный водород не выскользнул в воздух. Поскольку газ менее плотен, чем жидкость, он будет подниматься к верху пробирки по мере создания.
- Вы также можете накрыть пробирку другой пробиркой или просто положить сверху большой палец.
- Подождите не менее минуты, чтобы в трубке накопилось количество газа.
Часть 2 из 3: Тестирование на скрипучий треск

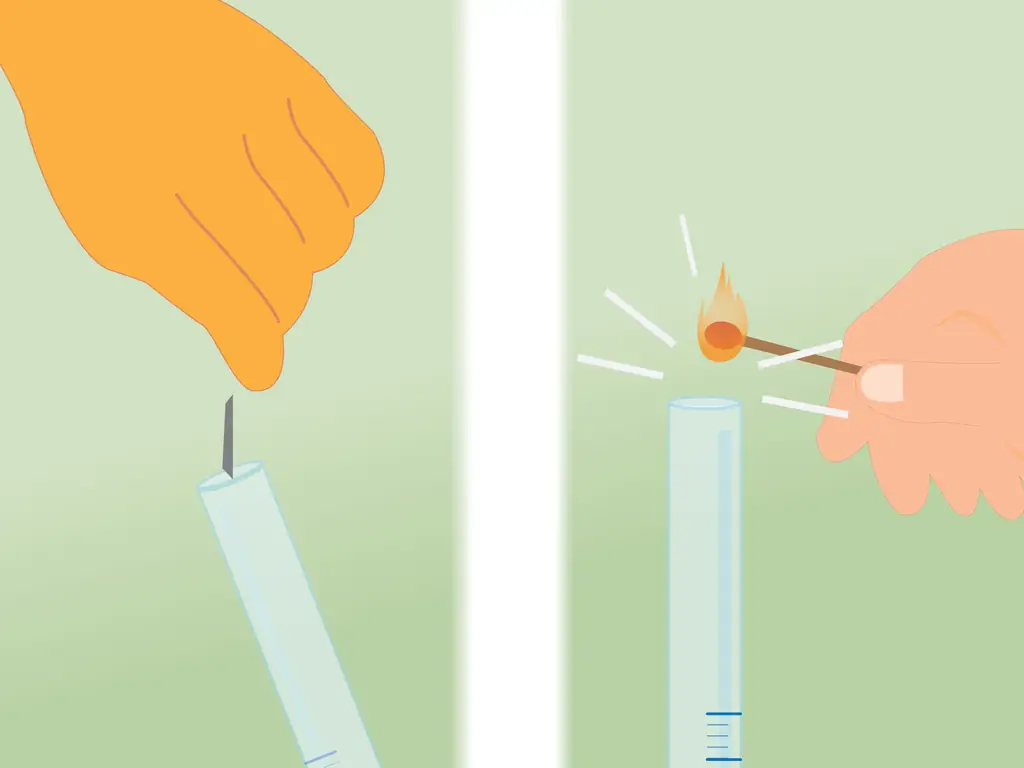
Шаг 1. Зажгите спичку
Для этого не обязательно использовать спичку, но вам нужно что-то, что горит. Вы можете использовать зажигалку, если хотите. Какой бы источник пламени вы ни использовали, зажгите его и поставьте рядом с трубкой, как только снимете покрытие.
При работе с открытым огнем необходим присмотр взрослых

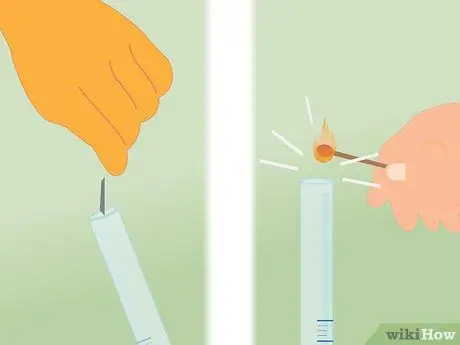
Шаг 2. Снимите покрытие с трубки
Снимите резиновую ленту, удерживающую пластик на месте, а затем снимите пластик с верхней части трубки. После открытия трубки немедленно переходите к следующему шагу, чтобы не допустить утечки слишком большого количества газа.
Как только покрытие будет снято, водород начнет улетучиваться в окружающий воздух

Шаг 3. Поместите спичку в верхнюю часть трубки
Поднесите зажженную спичку к трубке сразу после ее открытия. Как только пламя соприкоснется с газом, он, скорее всего, погаснет, но при этом вы услышите характерный «скрипучий хлопок».
- Будьте осторожны во время этого процесса. Вы работаете с горючими газами и открытым огнем.
- Выполняйте это под присмотром взрослых.
- Если вы не слышите хлопка, вероятно, в трубке недостаточно газа. Восстановите его и позвольте реакции длиться более длительное время. Убедитесь, что раствор бурлит.
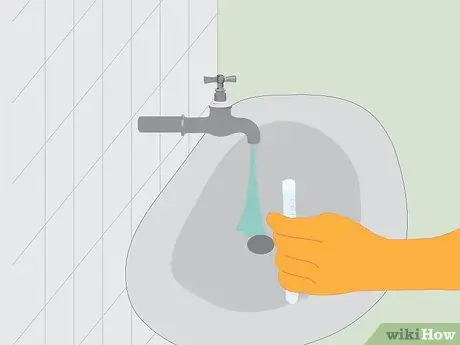
Шаг 4. Утилизируйте все как следует
Удалите металл из пробирки с помощью пинцета. Разведите соляную кислоту примерно в 4 литрах (1,1 галлона США) воды. Затем слейте разбавленный раствор в канализацию, одновременно подливая немного воды. Промойте металл в раковине, а затем выбросьте его в мусорное ведро.
- Вы также можете сохранить металл и использовать его снова, чтобы повторить эксперимент, если хотите.
- Обязательно ознакомьтесь с правилами утилизации соляной кислоты в вашем регионе, поскольку они различаются.
Часть 3 из 3: Использование эксперимента

Шаг 1. Создайте учебные цели
Основная цель обучения этому типу экспериментов - поговорить о химических реакциях. Этот конкретный эксперимент является примером реакции металлов с кислотами с образованием газов. Студенты смогут собственными глазами увидеть, насколько химически активен металл и как быстро в результате реакции образуется газ.
Вторичной целью может быть обсуждение безопасности лаборатории и работы с горючими газами
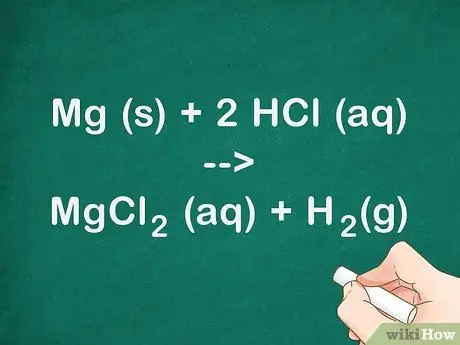
Шаг 2. Обсудите возникшую реакцию
Поговорите о том, как кислота реагирует с металлом. Обсуждая химические реакции, вы хотите поговорить о реагентах и о том, как они соединяются вместе, образуя различные продукты. Поговорите о состояниях, в которых существуют продукты и реагенты. Магний - это твердое вещество, которое реагирует с водной соляной кислотой с образованием газообразного водорода и водного раствора хлорида магния.
- Химическое уравнение для этого эксперимента: Mg (s) + 2 HCl (водн.) MgCl2 (водн.) + H2(грамм).
- Эта реакция также известна как реакция однократного замещения, что означает, что магний заменяет водород, связанный с хлором, с образованием хлорида магния.

Шаг 3. Расскажите о применении эксперимента
Этот тип эксперимента - хороший способ проверить наличие небольшого количества газообразного водорода. Помните, что водород легко воспламеняется, поэтому, если вы подозреваете, что в нем присутствует много газообразного водорода, вы не захотите проводить этот тест.
В контролируемой лабораторной обстановке, где вы знаете, что эксперимент должен производить водород, вы можете использовать этот тест для подтверждения
Шаг 4. Расширьте эксперимент другими металлами
Предоставьте студентам другие типы металлов, такие как железо, алюминий, медь и цинк. Проделайте ту же самую процедуру, а затем проверьте наличие газообразного водорода. Вы заметите, что не все типы реагируют с соляной кислотой с образованием газообразного водорода.
- Проделайте тот же эксперимент, но немного согрейте кислоту. Вы заметите, что большее количество металлов будет реагировать с образованием газообразного водорода, когда кислота теплая.
- Обсудите результаты со своими учениками.