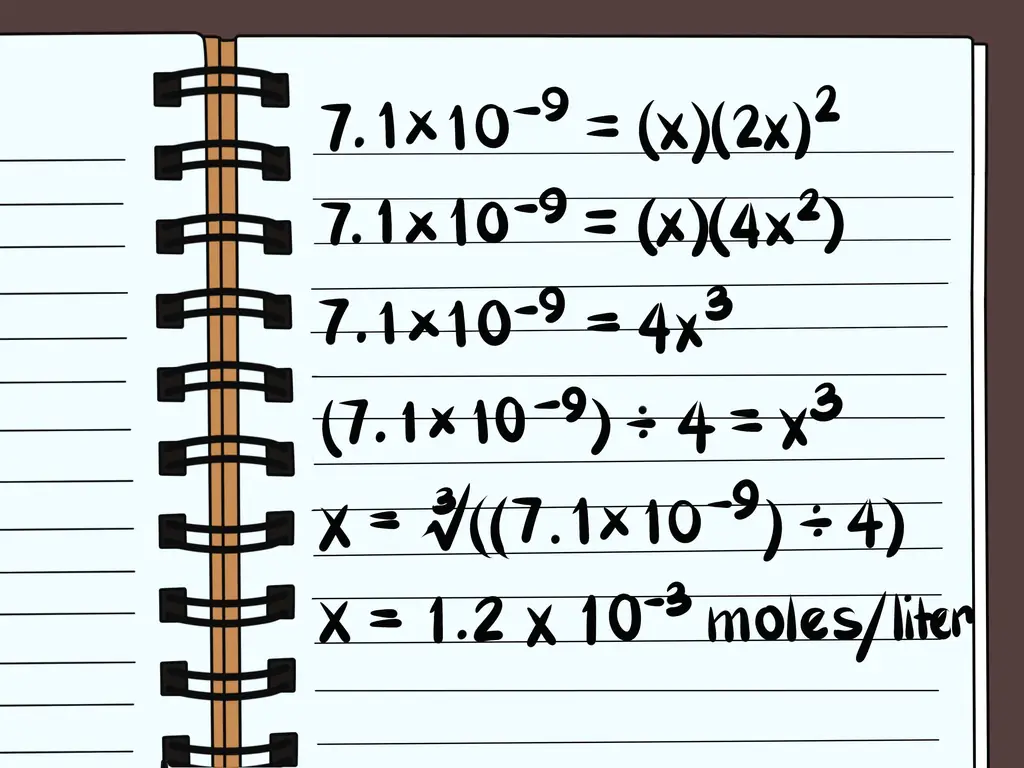Растворимость используется в химии для описания свойств твердого соединения, которое смешивается с жидкостью и полностью растворяется в ней, не оставляя нерастворенных частиц. Растворимы только ионные (заряженные) соединения. Для практических целей достаточно запомнить несколько правил или обратиться к их списку, чтобы сказать вам, останется ли большинство ионных соединений твердыми при попадании в воду или их значительное количество растворится. На самом деле некоторое количество молекул растворится, даже если вы не видите изменения, поэтому для точных экспериментов вам может потребоваться знать, как рассчитать это количество.
Шаги
Метод 1 из 2: Использование быстрых правил
Шаг 1. Узнайте об ионных соединениях
Каждый атом обычно имеет определенное количество электронов, но иногда они забирают лишний электрон или теряют его в результате процесса, известного как перенос электрона. В результате ион, имеющий электрический заряд. Когда ион с отрицательным зарядом (дополнительный электрон) встречает ион с положительным зарядом (без электрона), они связываются вместе, как отрицательный и положительный концы двух магнитов. В результате получается ионное соединение.
- Ионы с отрицательными зарядами называются анионы, а ионы с положительным зарядом - катионы.
- Обычно количество электронов в атоме равно количеству протонов, что нейтрализует электрические заряды.

Шаг 2. Понять растворимость
Молекулы воды (H2O) имеют необычную структуру, которая делает их похожими на магнит: один конец имеет положительный заряд, а другой - отрицательный. Когда вы бросаете ионное соединение в воду, эти водные «магниты» собираются вокруг него, пытаясь разделить положительные и отрицательные ионы.
- Некоторые ионные соединения плохо склеиваются; эти растворимый так как вода разделит их и растворит их. Другие соединения связаны более прочно и являются нерастворимый поскольку они могут склеиваться, несмотря на молекулы воды.
- У некоторых соединений есть внутренние связи, которые по силе схожи с силой притяжения воды. Они называются слабо растворимый, так как значительное количество соединений будет разделено, а остальные останутся вместе.
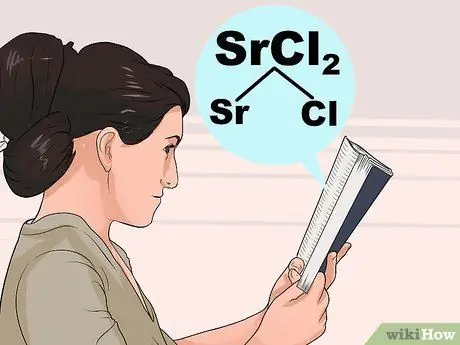
Шаг 3. Изучите правила растворимости
Поскольку взаимодействия между атомами довольно сложны, не всегда интуитивно понятно, какие соединения растворимы, а какие нерастворимы. Найдите первый ион в соединении в списке ниже, чтобы узнать, как он обычно себя ведет, затем проверьте исключения, чтобы убедиться, что второй ион не имеет необычного взаимодействия.
- Например, чтобы проверить хлорид стронция (SrCl2), ищите Sr или Cl в шагах, указанных ниже жирным шрифтом. Cl «обычно растворим», поэтому проверьте под ним исключения. Sr не указан в качестве исключения, поэтому SrCl2 должен быть растворимым.
- Под ним написаны наиболее распространенные исключения из каждого правила. Есть и другие исключения, но вряд ли вы встретите их на обычном уроке химии или в лаборатории.
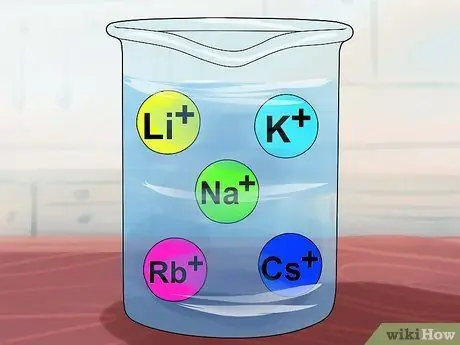
Шаг 4. Признайте, что соединения растворимы, если они содержат щелочные металлы
Щелочные металлы включают Li+, Na+, К+, Руб.+, а Cs+. Их также называют элементами группы IA: литий, натрий, калий, рубидий и цезий. Почти каждое соединение, которое включает один из этих ионов, растворимо.
-
Исключение:
Ли3PO4 нерастворим.
Шаг 5. Поймите, что некоторые другие соединения растворимы
К ним относятся соединения NO3-, С2ЧАС3О2-, НЕТ2-, ClO3-, и ClO4-. Соответственно, это ионы нитрата, ацетата, нитрита, хлората и перхлората. Обратите внимание, что ацетат часто обозначают сокращенно OAC.
-
Исключения:
Ag (OAc) (ацетат серебра) и Hg (OAc)2 (ацетат ртути) нерастворимы.
- AgNO2- и KClO4- только «слабо растворимы».
Шаг 6. Обратите внимание, что соединения Cl-, Br-, и я- обычно растворимы.
Ионы хлорида, бромида и йодида почти всегда образуют растворимые соединения, называемые солями галогенов.
-
Исключение:
Если какая-либо из этих пар с ионами серебра Ag+, ртуть Hg22+, или свинец Pb2+, результат нерастворим. То же самое относится и к менее распространенным соединениям, полученным путем спаривания с медью Cu.+ и таллий Tl+.

Шаг 7. Осознайте, что соединения, содержащие SO42- обычно растворимы.
Сульфат-ион обычно образует растворимые соединения, но есть несколько исключений.
-
Исключения:
Сульфат-ион образует нерастворимые соединения со следующими ионами: стронций Sr2+, барий Ba2+, свинец Pb2+, серебро Ag+, кальций Ca2+, радий Ra2+, и двухатомное серебро Ag22+. Обратите внимание, что сульфат серебра и сульфат кальция растворяются ровно настолько, что некоторые называют их слаборастворимыми.
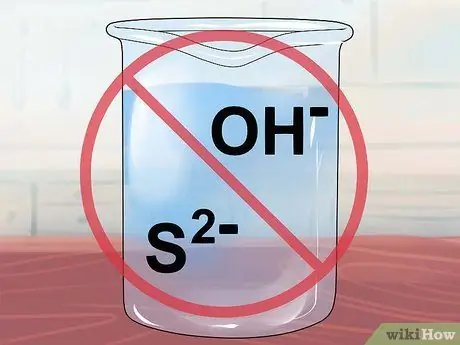
Шаг 8. Знайте, что соединения, содержащие ОН- или S2- нерастворимы.
Это ионы гидроксида и сульфида соответственно.
-
Исключения:
Помните щелочные металлы (Группа I-A) и то, как они любят образовывать растворимые соединения? Ли+, Na+, К+, Руб.+, а Cs+ все образуют растворимые соединения с ионами гидроксида или сульфида. Кроме того, гидроксид образует растворимые соли с ионами щелочноземельных металлов (Группа II-A): кальций Ca2+, стронций Sr2+, и барий Ba2+. Обратите внимание, что соединения, полученные из гидроксида и щелочноземельного металла, действительно имеют достаточно молекул, которые остаются связанными, чтобы их иногда считали «слабо растворимыми».
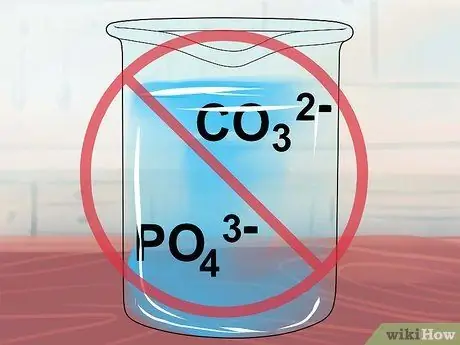
Шаг 9. Помните, что соединения, содержащие CO32- или ПО43- нерастворимы.
Последняя проверка на карбонатные и фосфат-ионы, и вы должны знать, чего ожидать от вашего соединения.
-
Исключения:
Эти ионы образуют растворимые соединения с обычными подозреваемыми щелочными металлами Li.+, Na+, К+, Руб.+, а Cs+, а также с аммонием NH4+.
Метод 2 из 2: Расчет растворимости по Kзр

Шаг 1. Найдите константу растворимости продукта (Kзр).
Эта константа отличается для каждого соединения, поэтому вам нужно будет найти ее в таблице в своем учебнике. Поскольку эти значения определяются экспериментально, они могут сильно различаться между диаграммами, поэтому лучше использовать таблицу из учебника, если она есть. Если не указано иное, в большинстве диаграмм предполагается, что вы работаете при 25ºC (77ºF).
Например, если вы растворяете йодид свинца или PbI2запишите константу растворимости его продукта.
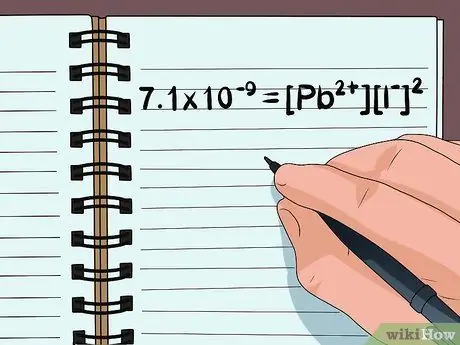
Шаг 2. Напишите химическое уравнение
Во-первых, определите, как соединение распадается на ионы при растворении. Затем напишите уравнение с Kзр с одной стороны, а составляющие ионы - с другой.
- Например, молекула PbI2 расщепляется на ионы Pb2+, Я-, а второй я-. (Вам нужно знать или найти заряд одного иона, поскольку вы знаете, что все соединение всегда будет иметь нейтральный заряд.)
- Напишите уравнение 7,1 × 10-9 = [Pb2+][Я-]2
- Уравнение представляет собой константу растворимости продукта, которую можно найти для 2 ионов в диаграмме растворимости. Поскольку есть 2 я- ионы, I- во второй степени.
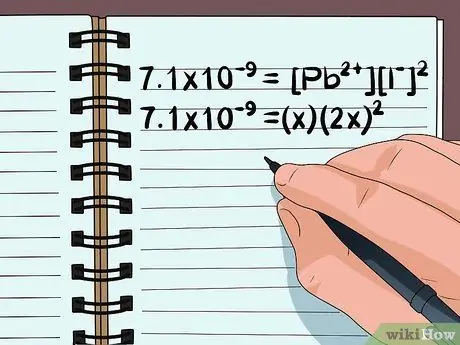
Шаг 3. Измените уравнение, чтобы использовать переменные
Перепишите уравнение как простую задачу алгебры, используя то, что вы знаете о количестве молекул и ионов. Установите x равным количеству соединения, которое будет растворяться, и перепишите переменные, представляющие номера каждого иона, в единицах x.
- В нашем примере нам нужно переписать 7.1 × 10-9 = [Pb2+][Я-]2
- Поскольку имеется 1 ион свинца (Pb2+) в соединении количество растворенных молекул соединения будет равно количеству свободных ионов свинца. Таким образом, мы можем установить [Pb2+] к x.
- Так как есть 2 иона йода (I-) для каждого иона свинца можно установить количество атомов йода равным 2x в квадрате.
- Уравнение теперь 7,1 × 10-9 = (х) (2х)2

Шаг 4. Учет общих ионов, если они есть
Пропустите этот шаг, если вы растворяете соединение в чистой воде. Однако, если соединение растворяется в растворе, который уже содержит один или несколько составляющих ионов («обычный ион»), растворимость значительно снижается. Эффект обычного иона наиболее заметен в соединениях, которые в основном нерастворимы, и в этих случаях можно предположить, что подавляющее большинство ионов в равновесии происходит от иона, уже присутствующего в растворе. Перепишите уравнение, включив в него известную молярную концентрацию (моль на литр или M) ионов, уже находящихся в растворе, заменив значение x, которое вы использовали для этого иона.
Например, если наше соединение иодида свинца растворялось в растворе с 0,2 М хлоридом свинца (PbCl2), мы бы переписали наше уравнение как 7.1 × 10-9 = (0,2M + x) (2x)2. Затем, поскольку 0,2M - это такая более высокая концентрация, чем x, мы можем смело переписать ее как 7,1 × 10-9 = (0,2 млн) (2x)2.
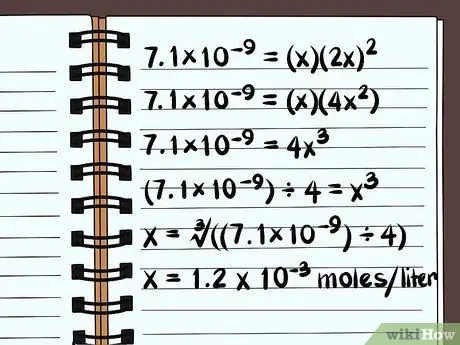
Шаг 5. Решите уравнение
Решите относительно x, и вы узнаете, насколько растворимо это соединение. Из-за того, как определяется константа растворимости, ваш ответ будет выражаться в молях растворенного соединения на литр воды. Чтобы найти окончательный ответ, вам может понадобиться калькулятор.
- Ниже приведены данные о растворимости в чистой воде, а не с обычными ионами.
- 7.1×10-9 = (х) (2х)2
- 7.1×10-9 = (х) (4x2)
- 7.1×10-9 = 4x3
- (7.1×10-9) ÷ 4 = х3
- х = ∛ ((7,1 × 10-9) ÷ 4)
- х = 1,2 х 10-3 моль на литр растворяется. Это очень небольшое количество, поэтому вы знаете, что это соединение практически нерастворимо.
Видео - с помощью этой службы некоторая информация может быть передана YouTube
подсказки
Если у вас есть экспериментальные данные о том, сколько соединения растворилось, вы можете использовать то же уравнение для определения константы растворимости Kзр.
Предупреждения
- Не существует общепринятого определения этих терминов, но химики согласны с большинством соединений. Некоторые соединения крайнего случая со значительными количествами как растворенных, так и нерастворенных молекул могут быть описаны по-разному в разных таблицах растворимости.
- Некоторые старые учебники перечисляют NH4ОН как растворимое соединение. Это неверно; небольшое количество NH4+ и ОН- ионы могут быть обнаружены, но они не могут быть выделены для образования соединения.