Хотя все атомы одного и того же элемента содержат одинаковое количество протонов, их количество нейтронов может варьироваться. Знание того, сколько нейтронов содержится в конкретном атоме, может помочь вам определить, является ли он обычным атомом этого элемента или изотопом, у которого будет либо больше, либо меньше нейтронов. Определить количество нейтронов в атоме довольно просто и даже не нужно экспериментировать. Чтобы рассчитать количество нейтронов в обычном атоме или изотопе, все, что вам нужно сделать, это следовать этим инструкциям с периодической таблицей в руке.
Шаги
Метод 1 из 2: определение количества нейтронов в обычном атоме
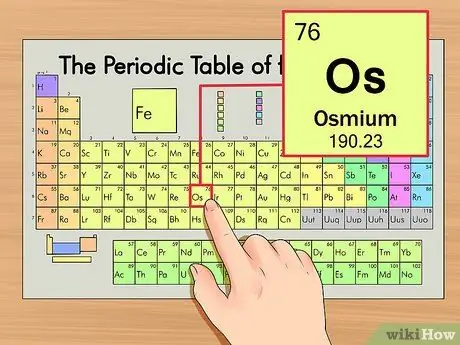
Шаг 1. Найдите элемент в периодической таблице
В этом примере мы рассмотрим осмий (Os), который находится в шестой строке вниз.
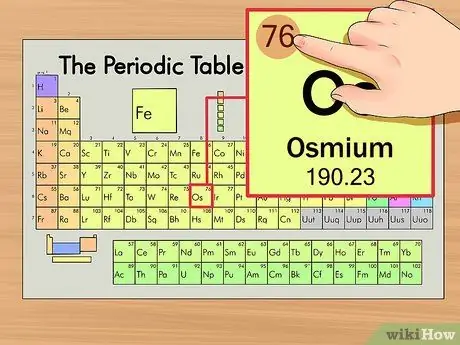
Шаг 2. Найдите атомный номер элемента
Обычно это наиболее заметное число, относящееся к данному элементу, и обычно оно находится над символом элемента, либо в середине поля, либо в верхнем левом углу. (Фактически, на диаграмме, которую мы используем, другие числа не указаны.) Атомный номер - это количество протонов в одном атоме этого элемента.
Os - это число 76, что означает, что один атом осмия содержит 76 протонов.
Число протонов в элементе никогда не меняется; это в основном то, что делает этот элемент таким элементом
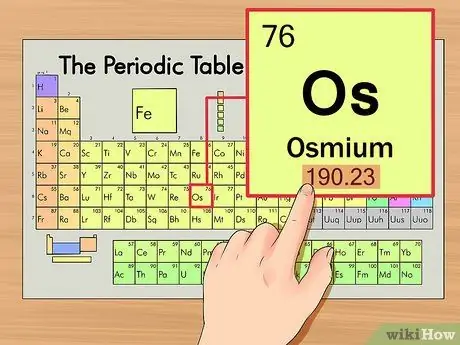
Шаг 3. Найдите атомный вес элемента
Это число обычно находится под атомным символом. Обратите внимание, что диаграмма в этом примере основана исключительно на атомном номере и не указывает атомный вес. Обычно так бывает не всегда. Осмий имеет атомный вес 190,23.

Шаг 4. Округлите атомный вес до ближайшего целого числа, чтобы найти атомную массу
В нашем примере 190,23 будет округлено до 190, в результате чего атомная масса осмия будет равна 190.
Атомный вес - это среднее значение изотопов элемента, поэтому обычно это не целое число

Шаг 5. Вычтите атомный номер из атомной массы
Поскольку подавляющая часть массы атома состоит из его протонов и нейтронов, вычитание количества протонов (то есть атомного номера) из атомной массы даст вам рассчитанное количество нейтронов в атоме. Цифры после десятичной точки представляют собой обычно очень маленькую массу электронов в атоме. В нашем примере это: 190 (атомный вес) - 76 (количество протонов) = 114 (количество нейтронов).
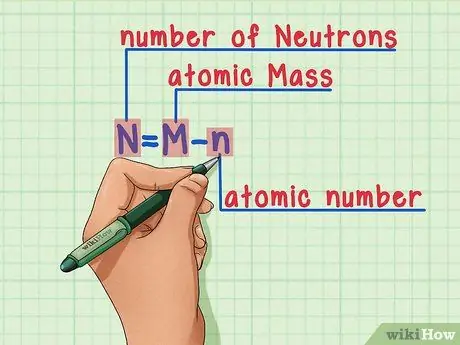
Шаг 6. Запомните формулу
Чтобы узнать количество нейтронов в будущем, просто используйте эту формулу:
-
N = M - n
- N = количество N эвтроны
- M = атомарный M жопа
-
n = атомный
умбра
Метод 2 из 2: определение количества нейтронов в изотопе
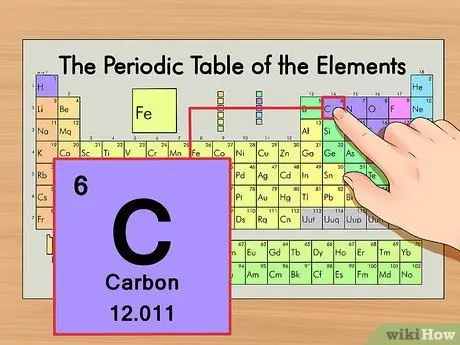
Шаг 1. Найдите элемент в периодической таблице
В качестве примера рассмотрим изотоп углерода-14. Поскольку неизотопная форма углерода-14 - это просто углерод (C), найдите углерод в периодической таблице (во второй строке вниз).
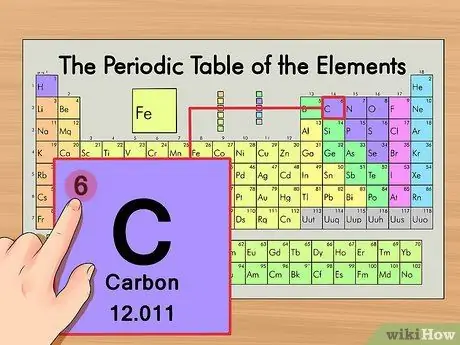
Шаг 2. Найдите атомный номер элемента
Обычно это наиболее заметное число, относящееся к данному элементу, и обычно оно находится над символом элемента. (Фактически, в нашем примере диаграммы другие числа не указаны.) Атомный номер - это количество протонов в одном атоме этого элемента.
C - число 6, что означает, что один атом углерода имеет 6 протонов.
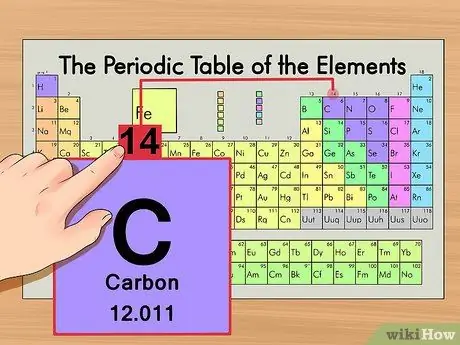
Шаг 3. Найдите атомную массу
Это невероятно просто с изотопами, так как они названы в соответствии с их атомной массой. Углерод-14, например, имеет атомную массу 14. Как только вы найдете атомную массу изотопа, процесс будет таким же, как и для определения количества нейтронов в обычном атоме.

Шаг 4. Вычтите атомный номер из атомной массы
Поскольку подавляющая часть массы атома состоит из его протонов и нейтронов, вычитание количества протонов (то есть атомного номера) из атомной массы даст вам рассчитанное количество нейтронов в атоме. В нашем примере это: 14 (атомная масса) - 6 (количество протонов) = 8 (количество нейтронов).
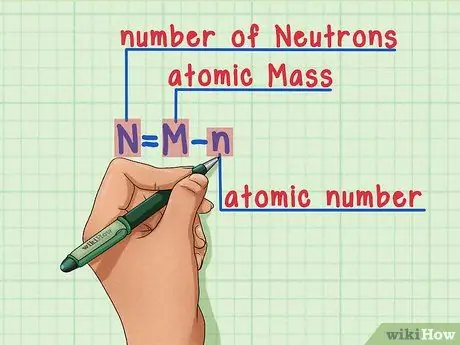
Шаг 5. Запомните формулу
Чтобы узнать количество нейтронов в будущем, просто используйте эту формулу:
-
N = M - n
- N = количество N эвтроны
- M = атомарный M жопа
-
n = атомный
умбра
Видео - с помощью этой службы некоторая информация может быть передана YouTube
подсказки
- Если вы когда-нибудь не уверены, какое число какое в периодической таблице, просто помните, что таблица обычно строится вокруг атомного номера (то есть числа протонов), который начинается с 1 (водород) и увеличивается на одну единицу за раз слева. вправо, до 118 (оганессон). Это потому, что количество протонов в атоме определяет, что это за атом, что делает его самой простой элементной чертой для организации. (Например, атом с двумя протонами всегда является гелием, так же как атом с 79 протонами всегда является золотом.)
- Протоны и нейтроны составляют почти весь вес элементов, тогда как электроны и различные частицы представляют собой незначительную массу (приближающуюся к нулевой массе). Поскольку один протон имеет примерно такой же вес, как и один нейтрон, а атомный номер представляет собой количество протонов, мы можем просто вычесть количество протонов из общей массы.
