Определение гибридизации может быть трудным. Этот wikiHow поможет вам определить молекулярную геометрию и гибридизацию молекулярного соединения. Сначала вы должны нарисовать структуру Льюиса или определить геометрию молекулы, чтобы помочь найти гибридизацию.
Шаги
Часть 1 из 4: Рисование скелетной структуры Льюиса

Шаг 1. Определите центральный атом
Наименее электроотрицательный атом будет центральным атомом.
В данном случае это йод
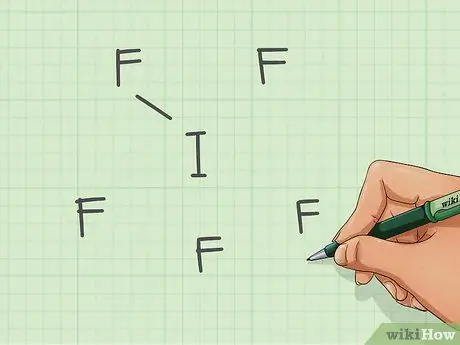
Шаг 2. Создайте связи, связанные с центральным атомом
Поскольку имеется 5 атомов фтора, вам понадобится 5 связей
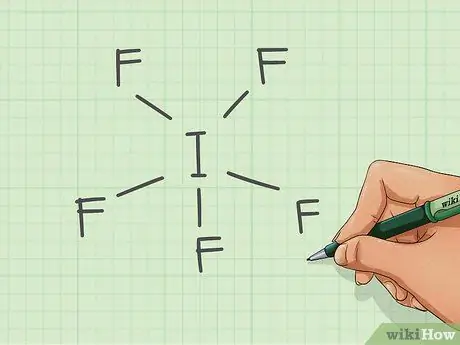
Шаг 3. Соедините оставшиеся атомы связями
Часть 2 из 4: Рисование полной структуры Льюиса

Шаг 1. Подсчитайте количество валентных электронов
Номера групп показывают, сколько валентных электронов имеет атом.
И иод, и фтор находятся в Группе 7A, что дает каждому атому по 7 электронов
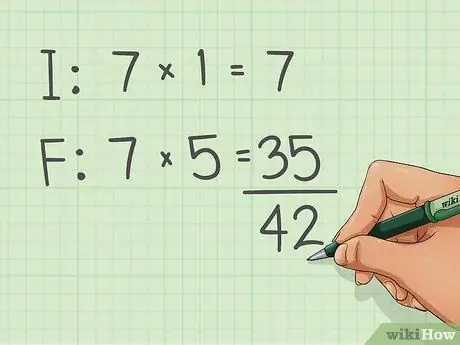
Шаг 2. Сложите общее количество электронов
- Йод имеет 7, а каждый фтор - 7.
- Поскольку фтора пять, вам нужно умножить семь электронов одного атома фтора на пять.
- 1 (7) + 5 (7) = 42 полных электрона.
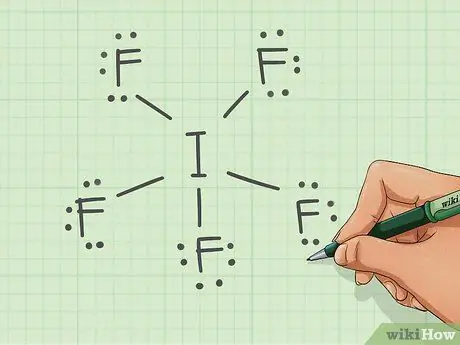
Шаг 3. Заполните самые удаленные атомы электронами
- Не забудьте следовать правилу октетов.
- Одиночные связи учитывают 2 электрона.
- Следовательно, дайте каждому атому фтора по 6 электронов.
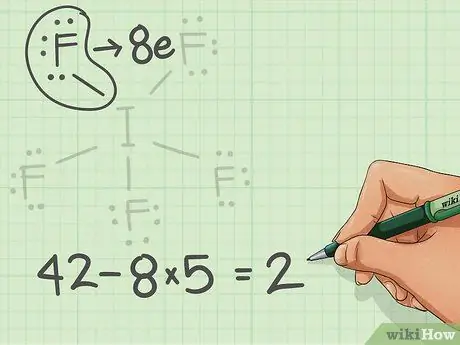
Шаг 4. Подсчитайте оставшиеся электроны
- Каждый атом фтора имеет вокруг себя 8 электронов, включая связывающие электроны.
- Это дает вам 40 электронов из 42.
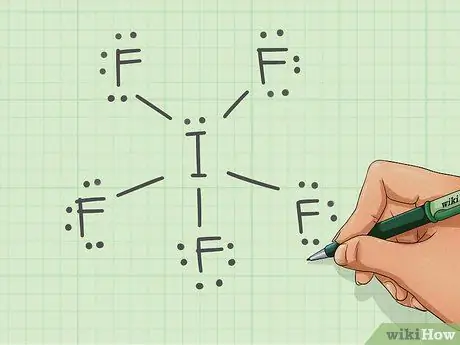
Шаг 5. Используйте оставшиеся электроны
- Вы должны использовать оставшиеся два электрона; так как все пять атомов фтора имеют восемь электронов, поместите оставшиеся электроны на йод.
- Йод является исключением из правила октетов, поскольку он может расширять свои орбитали, поскольку имеет подоболочку "d".
Часть 3 из 4: Определение молекулярной геометрии
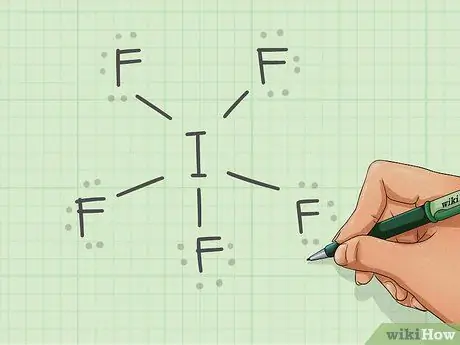
Шаг 1. Используйте структуру Льюиса, чтобы нарисовать форму
Помните, что неподеленные электронные пары не участвуют в геометрии молекулы. Используйте связки, чтобы нарисовать стороны формы.
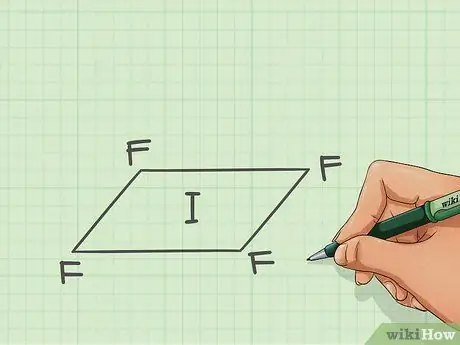
Шаг 2. Соедините каждый атом линией
В случае пентафторида йода, йод и четыре фтора создают квадрат для основания
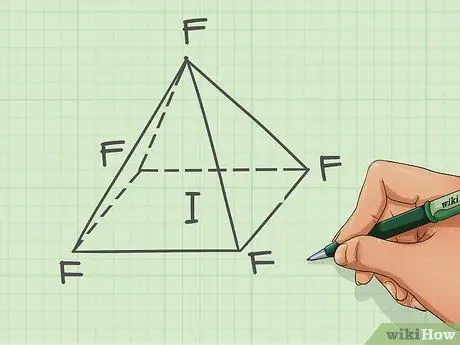
Шаг 3. Определите форму
- По форме пентафторид йода выглядит как пирамида с квадратным основанием.
- Таким образом, название молекулярной формы пентафторида йода - квадратно-пирамидальная.
Часть 4 из 4: Определение гибридизации
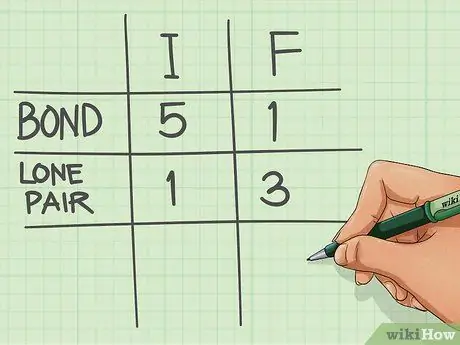
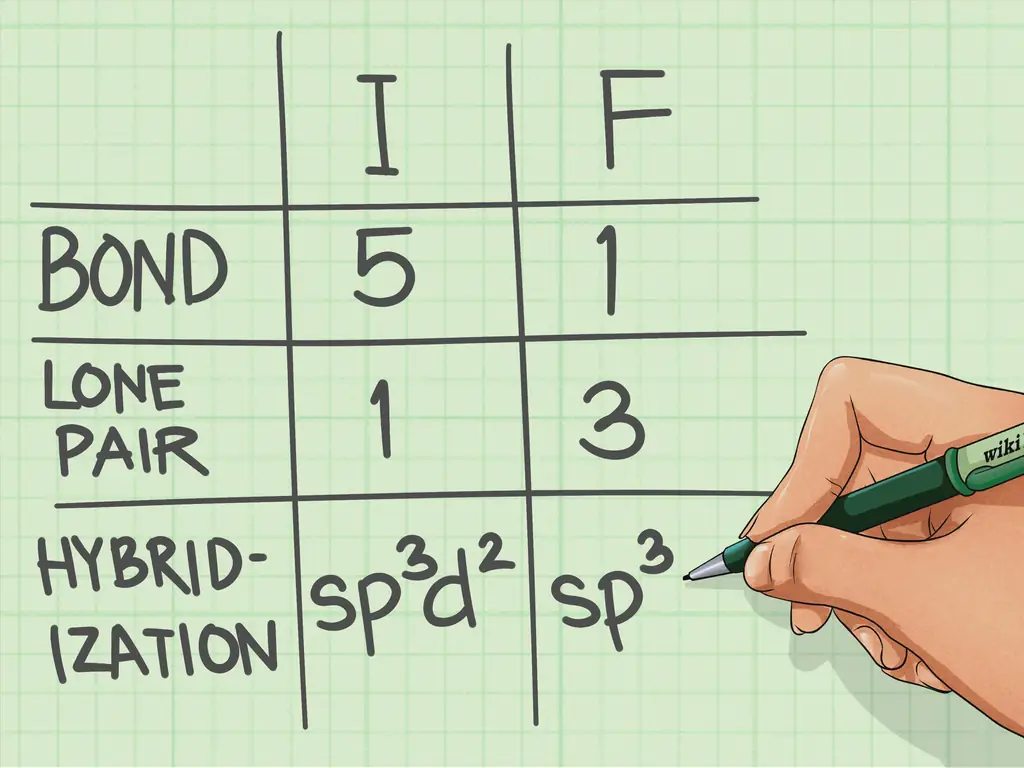
Шаг 1. Подсчитайте связи и неподеленные электронные пары, связанные с атомом
- Йод имеет 5 связей и 1 неподеленную электронную пару.
- Каждый фтор имеет 1 связь и 3 неподеленные электронные пары.

Шаг 2. Определите гибридизацию
- Поскольку у йода всего 5 связей и 1 неподеленная пара, гибридизация имеет вид sp3d2. Показатели степени на подоболочках должны составлять в сумме количество связей и неподеленных пар.
- Фтор имеет 1 связь и 3 неподеленные пары, что в сумме дает 4, что дает гибридизацию: sp3. Складывая экспоненты, получаем 4.