Атомная масса представляет собой сумму всех протонов, нейтронов и электронов в одном атоме или молекуле. Однако масса электрона настолько мала, что считается незначительной и не учитывается в расчетах. Хотя это технически неверно, этот термин также часто используется для обозначения средней атомной массы всех изотопов одного элемента. Это второе определение на самом деле является относительной атомной массой, также известной как атомный вес, элемента. Атомный вес учитывает средние массы встречающихся в природе изотопов одного и того же элемента. Химики должны различать эти два типа атомной массы, чтобы руководствоваться своей работой - неправильное значение атомной массы может, например, привести к неправильному расчету выхода эксперимента.
Шаги
Метод 1 из 3: определение показаний атомной массы по таблице Менделеева

Шаг 1. Понять, как представлена атомная масса
Атомная масса, масса данного атома или молекулы, может быть выражена в стандартных единицах массы СИ - граммах, килограммах и т. Д. Однако, поскольку атомные массы, выраженные в этих терминах, невероятно малы, атомная масса часто выражается в единых единицах. атомные единицы массы (обычно сокращаются до «у» или «аму») или в единицах Дальтона (Да). Стандарт для одной атомной единицы массы равен 1/12 массы стандартного изотопа углерода-12.
Атомная масса - это количество граммов элемента в одном моль атомов элемента. Это очень полезное свойство, когда дело доходит до практических расчетов, поскольку оно позволяет легко конвертировать между массой и молями данного количества атомов или молекул одного типа

Шаг 2. Найдите атомную массу в периодической таблице
В большинстве стандартных периодических таблиц перечислены относительные атомные массы (атомные веса) каждого элемента. Это почти всегда записывается в виде числа внизу квадрата элемента в таблице под его одно- или двухбуквенным химическим символом. Это число обычно выражается в виде десятичной дроби, а не целого числа.
- Обратите внимание, что относительные атомные массы, указанные в периодической таблице, являются средними значениями для соответствующего элемента. Химические элементы имеют разные изотопы - химические формы, которые различаются по массе из-за добавления или вычитания одного или нескольких нейтронов к ядру атома. Таким образом, относительная атомная масса, указанная в периодической таблице, подходит в качестве среднего значения для атомов определенного элемента, но нет как масса одного атома этого элемента.
- Относительные атомные массы, указанные в периодической таблице, используются для расчета молярных масс атомов и молекул. Атомные массы, выраженные в а.е.м., как в периодической таблице, технически безразмерны. Однако, просто умножив атомную массу на 1 г / моль, можно получить работоспособное количество молярной массы элемента - массу (в граммах) одного моля атомов элемента.
- Например, атомная масса железа составляет 55,847 а.е.м., что означает, что один моль атомов железа будет весить 55,847 грамма.

Шаг 3. Поймите, что значения в таблице Менделеева представляют собой среднюю атомную массу элемента
Как уже отмечалось, относительные атомные массы, указанные для каждого элемента в периодической таблице, являются средними значениями всех изотопов атома. Это среднее значение полезно для многих практических расчетов - таких как, например, расчет молярной массы молекулы, состоящей из нескольких атомов. Однако при работе с отдельными атомами этого количества иногда бывает недостаточно.
- Поскольку это среднее значение для нескольких различных типов изотопов, значение в периодической таблице не является точным значением для атомной массы отдельного атома.
- Атомные массы для отдельных атомов должны быть рассчитаны с учетом точного количества протонов и нейтронов в одном атоме.
Метод 2 из 3: Расчет атомной массы отдельного атома
Шаг 1. Найдите атомный номер элемента или изотопа
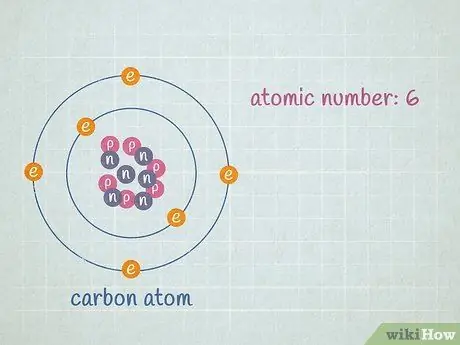
Атомный номер - это количество протонов в элементе, которое никогда не меняется. Например, все атомы водорода и только атомы водорода имеют 1 протон. У натрия атомный номер 11, потому что его ядро имеет 11 протонов, а кислород имеет атомный номер 8, потому что его ядро имеет 8 протонов. Вы можете найти атомный номер любого элемента в периодической таблице - почти во всех стандартных периодических таблицах: это номер над одно- или двухбуквенным химическим символом элемента. Это число всегда будет положительным целым числом.
- Допустим, мы работаем с атомом углерода. Углерод всегда имеет 6 протонов, поэтому мы знаем, что его атомный номер равен 6. Мы также можем видеть в периодической таблице, что квадрат для углерода (C) имеет цифру «6» вверху, что означает, что атомный номер углерода равен 6.
- Обратите внимание, что атомный номер элемента не имеет прямого отношения к его относительной атомной массе, указанной в периодической таблице. Хотя, особенно среди элементов в верхней части периодической таблицы, может показаться, что атомная масса атома примерно вдвое больше его атомного номера, атомная масса никогда не рассчитывается путем удвоения атомного номера элемента.
Шаг 2. Найдите количество нейтронов в ядре
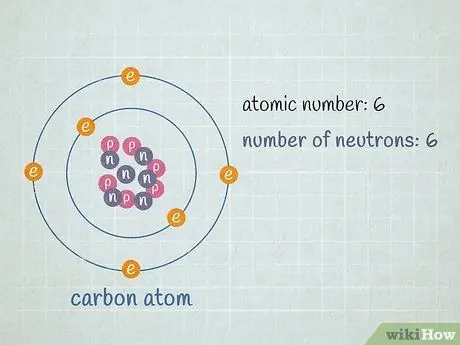
Число нейтронов может варьироваться между атомами определенного элемента. Хотя два атома с одинаковым числом протонов и разным числом нейтронов являются одним и тем же элементом, это разные изотопы этого элемента. В отличие от количества протонов в элементе, которое никогда не меняется, количество нейтронов в атомах определенного элемента может меняться достаточно часто, поэтому средняя атомная масса элемента должна быть выражена в виде десятичного числа между двумя целыми числами.
- Число нейтронов можно определить по изотопному обозначению элемента. Например, углерод-14 - это встречающийся в природе радиоактивный изотоп углерода-12. Вы часто будете видеть изотоп, обозначенный цифрой как надстрочный индекс перед символом элемента: 14C. Количество нейтронов рассчитывается путем вычитания количества протонов из изотопного числа: 14-6 = 8 нейтронов.
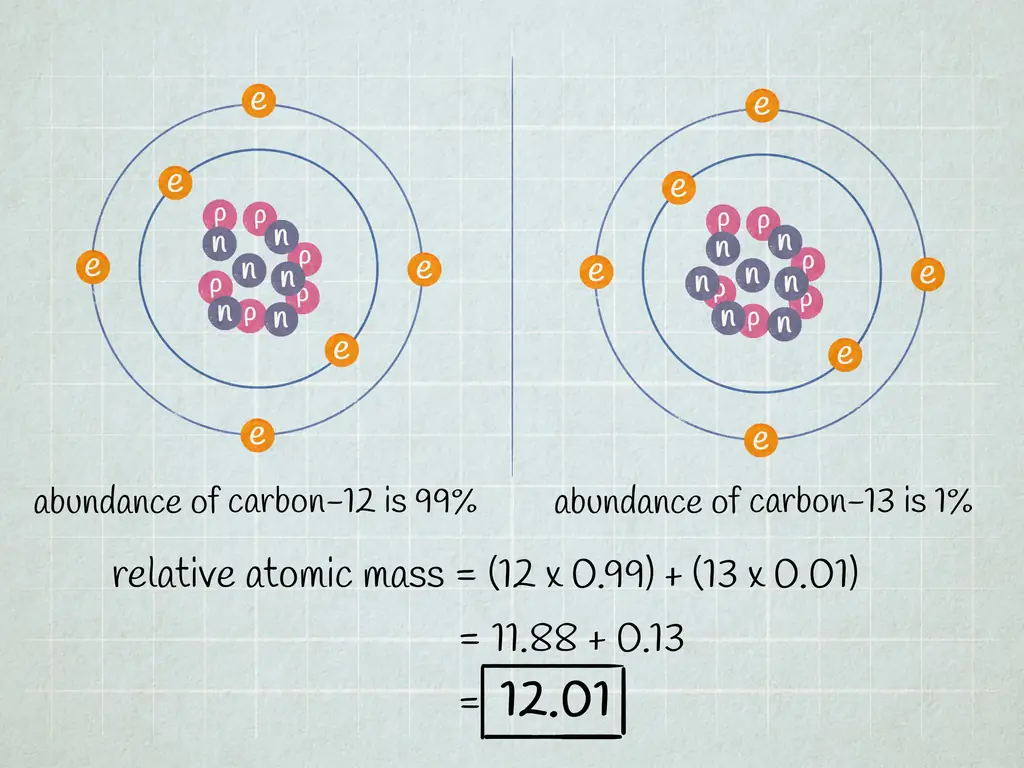
- Допустим, у атома углерода, с которым мы работаем, шесть нейтронов (12C). Это, безусловно, самый распространенный изотоп углерода, на его долю приходится почти 99% всех атомов углерода. Однако около 1% атомов углерода имеют 7 нейтронов (13C). Другие типы атомов углерода с более или менее 6 или 7 нейтронами существуют в очень небольших количествах.
Шаг 3. Сложите счетчик протонов и нейтронов
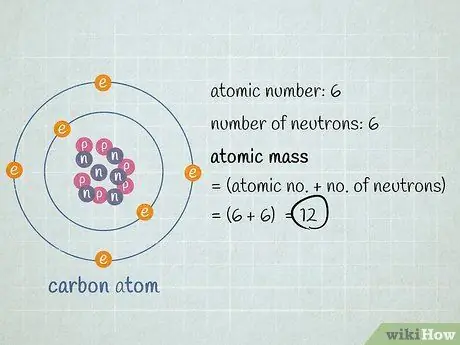
Это атомная масса этого атома. Не беспокойтесь о количестве электронов, вращающихся вокруг ядра - их совокупная масса очень и очень мала, поэтому в большинстве практических случаев это не окажет существенного влияния на ваш ответ.
- У нашего атома углерода 6 протонов + 6 нейтронов = 12. Атомная масса этого конкретного атома углерода равна 12. Если бы это был изотоп углерода-13, с другой стороны, мы бы знали, что он имеет 6 протонов + 7 нейтронов = 1 атомный вес 13.
- Фактический атомный вес углерода-13 составляет 13,003355, что является более точным, поскольку он был определен экспериментально.
- Атомная масса очень близка к изотопному числу элемента. Для основных расчетных целей число изотопа равно атомной массе. При экспериментальном определении атомная масса немного превышает изотопное число из-за очень небольшого вклада электронов в массу.
Метод 3 из 3: Расчет относительной атомной массы (атомного веса) элемента
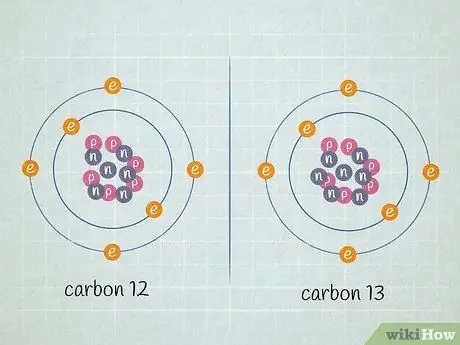
Шаг 1. Определите, какие изотопы находятся в образце
Химики часто определяют относительные пропорции изотопов в данном образце с помощью специального инструмента, называемого масс-спектрометром. Однако на уровне школьников по химии эта информация часто предоставляется вам на школьных тестах и т. Д. В форме установленных значений из научной литературы.
Для наших целей предположим, что мы работаем с изотопами углерод-12 и углерод-13
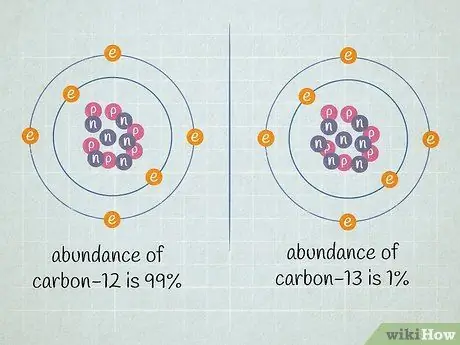
Шаг 2. Определите относительное содержание каждого изотопа в образце
В одном элементе разные изотопы встречаются в разных пропорциях. Эти пропорции почти всегда выражаются в процентах. Некоторые изотопы будут очень распространены, в то время как другие будут очень редкими - временами настолько редкими, что их едва ли можно будет обнаружить. Эту информацию можно определить с помощью масс-спектрометрии или из справочника.
Допустим, содержание углерода-12 составляет 99%, а содержание углерода-13 составляет 1%. Существуют и другие изотопы углерода, но они существуют в настолько малых количествах, что в этом примере задачи ими можно пренебречь
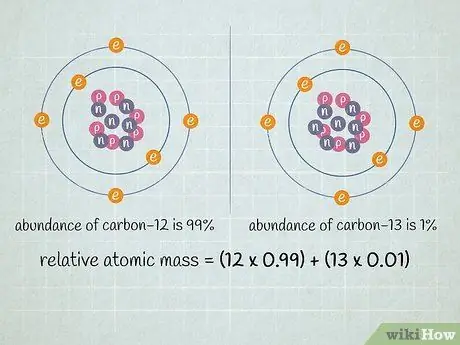
Шаг 3. Умножьте атомную массу каждого изотопа на его долю в образце
Умножьте атомную массу каждого изотопа на его процентное содержание (записанное в виде десятичной дроби). Чтобы преобразовать процент в десятичную дробь, просто разделите его на 100. Преобразованные проценты всегда должны составлять в сумме 1.
- Наш образец содержит углерод-12 и углерод-13. Если углерод-12 составляет 99% образца, а углерод-13 составляет 1% образца, умножьте 12 (атомная масса углерода-12) на 0,99 и 13 (атомная масса углерода-13) на 0,01.
- Справочник даст процентные пропорции, основанные на всех известных количествах изотопов элемента. Большинство учебников химии включают эту информацию в таблицу в конце книги. Масс-спектрометр также может определить пропорции исследуемого образца.
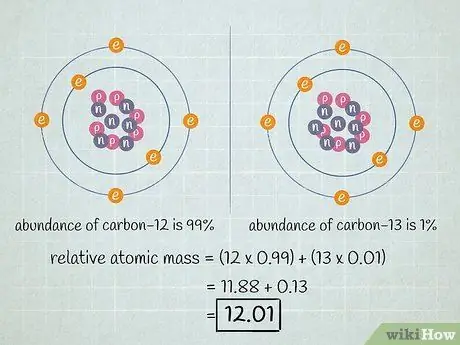
Шаг 4. Добавьте результаты
Просуммируйте произведения умножений, которые вы выполнили на предыдущем шаге. Результатом этого сложения является относительная атомная масса вашего элемента - среднее значение атомных масс изотопов вашего элемента. Это значение используется при обсуждении элемента в целом, а не конкретных изотопов этого элемента.