В химии электроотрицательность - это мера того, насколько сильно атом притягивает электроны в связи. Атом с высокой электроотрицательностью сильно притягивает электроны, а атом с низкой электроотрицательностью - слабо. Значения электроотрицательности используются для прогнозирования поведения различных атомов, когда они связаны друг с другом, что делает этот навык важным в базовой химии.
Шаги
Метод 1 из 3: основы электроотрицательности
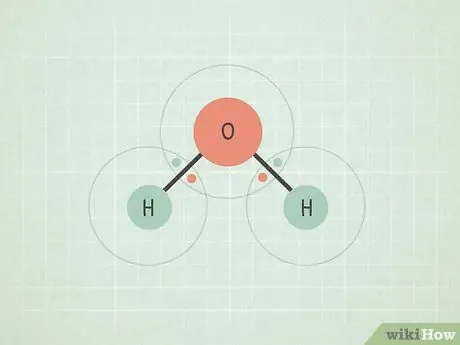
Шаг 1. Поймите, что химические связи возникают, когда атомы разделяют электроны
Чтобы понять электроотрицательность, важно сначала понять, что такое «связь». Говорят, что любые два атома в молекуле, которые «соединены» друг с другом на молекулярной диаграмме, имеют связь между собой. Это означает, что они разделяют набор из двух электронов, причем каждый атом вносит один электрон в связь.
Точные причины того, почему атомы разделяют электроны и связаны, выходят за рамки этой статьи. Если вы хотите узнать больше, ознакомьтесь с этой статьей об основах связи или собственной статьей WikiHow Как изучить природу химической связи (химия)
Шаг 2. Понять, как электроотрицательность влияет на электроны в связи
Когда два атома разделяют набор из двух электронов в связи, они не всегда делят их поровну. Когда один атом имеет более высокую электроотрицательность, чем атом, с которым он связан, он притягивает два электрона в связи ближе к себе. Атом с очень высокой электроотрицательностью может полностью потянуть электроны на свою сторону связи, почти не разделяя их с другим атомом.
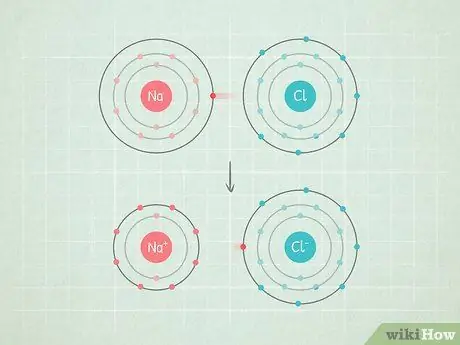
Например, в молекуле NaCl (хлорид натрия) атом хлорида имеет довольно высокую электроотрицательность, а натрий - довольно низкую. Таким образом, электроны будут вытягиваться к хлориду а также вдали от натрия.
Шаг 3. Используйте таблицу электроотрицательности в качестве справочной информации
Таблица электроотрицательности элементов имеет элементы, расположенные точно так же, как в периодической таблице, за исключением того, что каждый атом помечен своей электроотрицательностью. Их можно найти в различных учебниках по химии и технических статьях, а также в Интернете.
Вот ссылка на отличную таблицу электроотрицательности. Обратите внимание, что здесь используется шкала электроотрицательности Полинга, которая является наиболее распространенной. Однако есть и другие способы измерения электроотрицательности, один из которых будет показан ниже

Шаг 4. Запомните тенденции электроотрицательности для облегчения оценок
Если у вас нет под рукой таблицы электроотрицательности, вы все равно можете оценить силу электроотрицательности атома по сравнению с силой атома другого элемента в зависимости от того, где он находится в нормальной периодической таблице. Хотя вы не сможете рассчитать числовое значение, вы можете оценить разницу между электроотрицательностями двух разных элементов. Как общее правило:
- Электроотрицательность атома становится выше когда вы переходите к Правильно в периодической таблице.
- Электроотрицательность атома становится выше как вы двигаетесь вверх в периодической таблице.
- Таким образом, атомы в правом верхнем углу имеют самую высокую электроотрицательность, а атомы в нижнем левом углу - самую низкую.
- Например, в приведенном выше примере с NaCl вы можете сказать, что хлор имеет более высокую электроотрицательность, чем натрий, потому что он почти полностью находится в правом верхнем углу. С другой стороны, натрий находится далеко слева, что делает его одним из атомов более низкого ранга.
Метод 2 из 3: поиск связей с электроотрицательностью
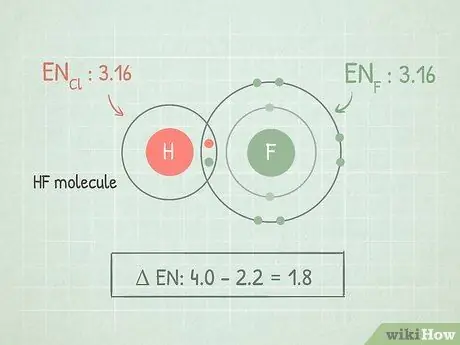
Шаг 1. Найдите разность электроотрицательностей между двумя атомами
Когда два атома связаны вместе, разница в их электроотрицательности может рассказать вам о качествах их связи. Вычтите меньшую электроотрицательность из большей, чтобы найти разницу.
Например, если мы смотрим на молекулу HF, мы должны вычесть электроотрицательность водорода (2.1) из фтора (4.0). 4,0 - 2,1 = 1.9
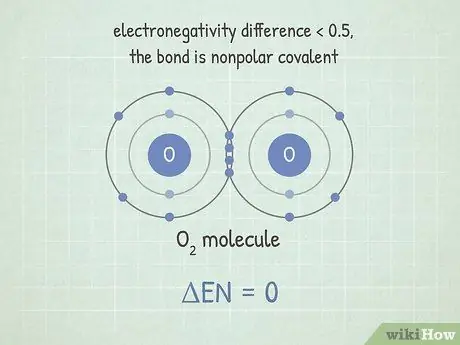
Шаг 2. Если разница меньше примерно 0,5, связь неполярная ковалентная
Здесь электроны распределены почти поровну. Эти связи не образуют молекулы с большой разницей заряда на обоих концах. Неполярные связи, как правило, очень трудно разорвать. Это потому, что атомы разделяют электроны, что делает их связь стабильной. Чтобы разорвать эту связь, требуется много энергии.
Например, молекула O2 имеет этот тип связи. Поскольку два кислорода имеют одинаковую электроотрицательность, разница между ними равна 0.
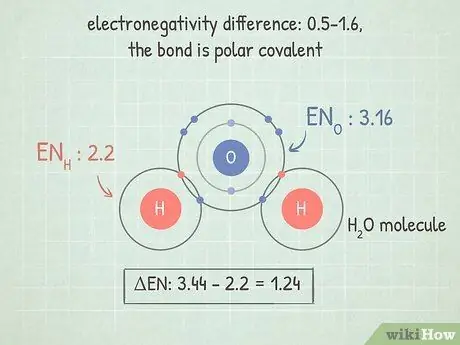
Шаг 3. Если разница составляет 0,5-1,6, связь полярная ковалентная
Эти связи имеют больше электронов на одном конце, чем на другом. Это делает молекулу немного более отрицательной на конце с электронами и немного более положительной на конце без них. Дисбаланс заряда в этих связях может позволить молекуле участвовать в определенных особых реакциях, таких как соединение с другим атомом или молекулой или отрыв молекулы. Это потому, что он все еще реактивный.
Хорошим примером этого является молекула H2О (вода). O является более электроотрицательным, чем два H, поэтому он более плотно удерживает электроны и делает всю молекулу частично отрицательной на O-конце и частично положительной на H-концах.
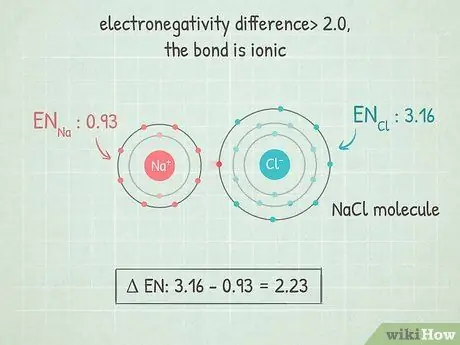
Шаг 4. Если разница больше 2,0, связь ионная
В этих связях электроны полностью находятся на одном конце связи. Более электроотрицательный атом получает отрицательный заряд, а менее электроотрицательный атом получает положительный заряд. Такие связи позволяют их атомам хорошо реагировать с другими атомами и даже разъединяться полярными молекулами.
- Примером этого является NaCl (хлорид или соль натрия). Хлор настолько электроотрицателен, что притягивает оба электрона в связи до самого себя, оставляя натрий с положительным зарядом.
- NaCl может быть разрушен полярной молекулой, такой как H2O (вода). В молекуле воды водородная сторона молекулы положительна, а кислородная сторона отрицательна. Когда вы смешиваете соль с водой, молекулы воды расщепляют молекулы соли, растворяя соль.
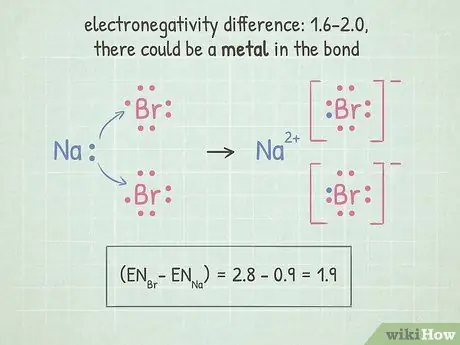
Шаг 5. Если разница между 1,6-2,0, проверьте наличие металла
Если там является металл в связи, связь ионная. Если есть только неметаллы, связь полярная ковалентная.
- Металлы включают большинство атомов в левой и средней частях таблицы Менделеева. На этой странице есть таблица, которая показывает, какие элементы являются металлами.
- Наш пример HF, приведенный выше, попадает в этот диапазон. Поскольку H и F не являются металлами, у них есть полярный ковалентный связь.
Метод 3 из 3: Найдите электроотрицательность Малликена

Шаг 1. Найдите первую энергию ионизации вашего атома
Электроотрицательность Малликена - это немного другой способ измерения электроотрицательности, чем тот, который используется в приведенной выше таблице Полинга. Чтобы найти электроотрицательность по Малликену для определенного атома, найдите первую энергию ионизации этого атома. Это энергия, необходимая для того, чтобы атом разрядил один электрон.
- Это то, что вам, вероятно, придется найти в справочных материалах по химии. На этом сайте есть хорошая таблица, которую вы, возможно, захотите использовать (прокрутите вниз, чтобы найти ее).
- В качестве примера предположим, что мы пытаемся найти электроотрицательность лития (Li). В таблице на сайте выше мы видим, что его первая энергия ионизации равна 520 кДж / моль.

Шаг 2. Найдите сродство атома к электрону
Это мера энергии, получаемой при добавлении электрона к атому с образованием отрицательного иона. Опять же, это то, что вам нужно найти в справочных материалах. На этом сайте есть ресурсы, которые вы, возможно, захотите просмотреть.
Электронное сродство лития 60 кДж моль-1.
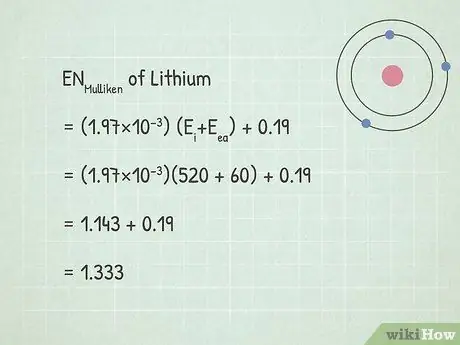
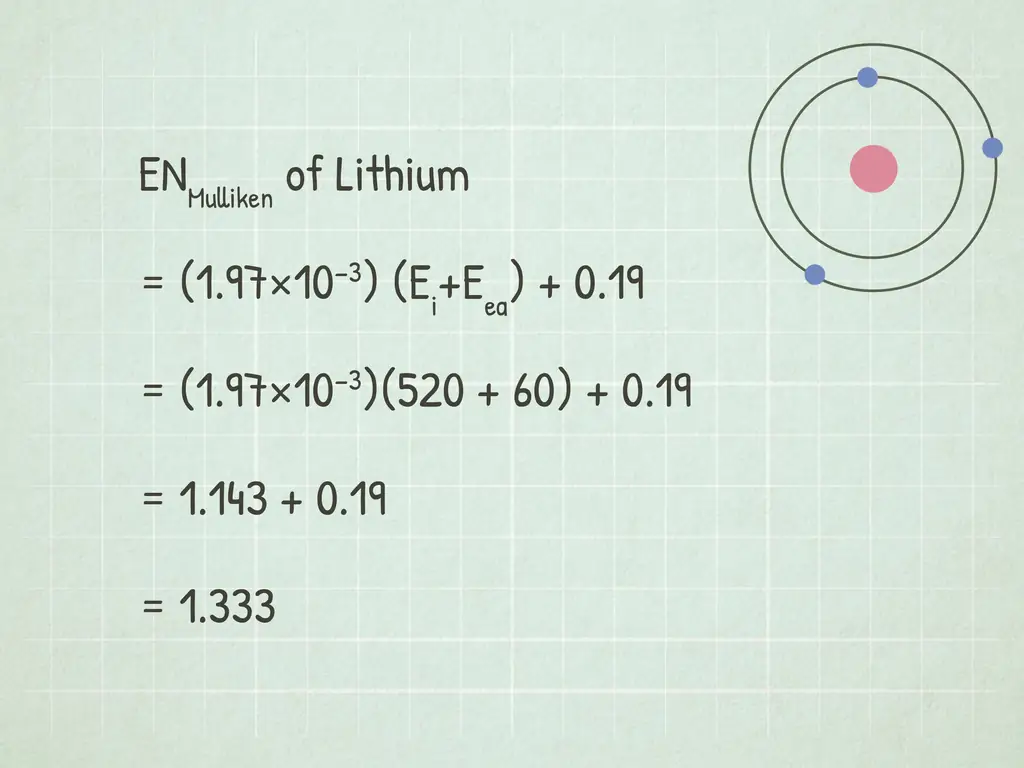
Шаг 3. Решите уравнение электроотрицательности Малликена
Когда вы используете кДж / моль в качестве единиц энергии, уравнение электроотрицательности Малликена выглядит следующим образом: ENMulliken = (1.97×10−3) (Eя+ Eеа) + 0.19. Подставьте свои значения в уравнение и решите для ENMulliken.
-
В нашем примере мы бы решили так:
-
- ENMulliken = (1.97×10−3) (Eя+ Eеа) + 0.19
- ENMulliken = (1.97×10−3)(520 + 60) + 0.19
- ENMulliken = 1.143 + 0.19 = 1.333
-
Видео - с помощью этой службы некоторая информация может быть передана YouTube
подсказки
- Электроотрицательность не имеет единиц.
- Помимо шкал Полинга и Малликена, к другим шкалам электроотрицательности относятся шкала Оллреда - Рохоу, шкала Сандерсона и шкала Аллена. Все они имеют свои собственные уравнения для расчета электроотрицательности (некоторые из которых могут быть довольно сложными).