Вода - одно из самых известных и повсеместно необходимых веществ на планете. Без него жизнь, которую мы знаем, была бы невозможна. Интересно, однако, что вода довольно сложна и трудна для понимания на некоторых из самых основных ее уровней. Он обладает свойствами, которыми не обладают другие жидкости, интересным образом связывается с самим собой и различными способами взаимодействует с другими химическими веществами.
Шаги
Метод 1 из 3: Определение основных химических свойств
Шаг 1. Представьте себе химическую формулу воды
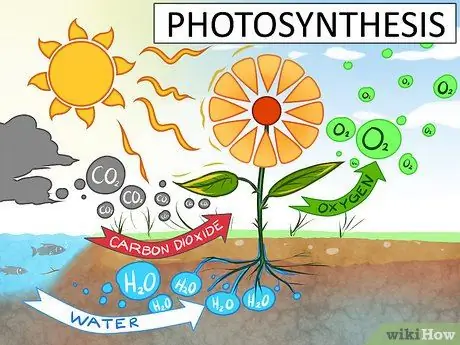
Зная, что такое химическая формула H2О на самом деле значит важно. Это означает, что вам нужны два атома водорода и один атом кислорода, чтобы образовать молекулу воды. Это также означает, что если вы разделите молекулу воды, вы получите два атома водорода и один кислород.
- Разделение воды часто выполняется с помощью электричества в процессе, известном как электролиз.
- Растения также расщепляют воду для фотосинтеза.
Шаг 2. Подумайте, как молекулы воды сочетаются друг с другом
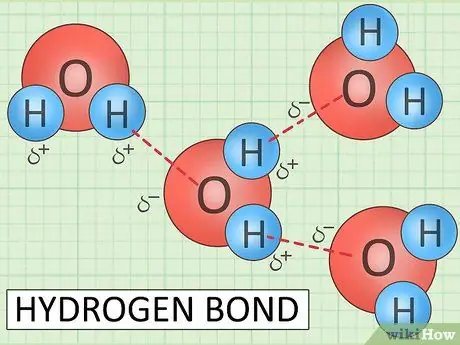
Кислород и водород одной молекулы воды связаны ковалентной связью. То есть у них общие электроны. Однако молекулы воды также испытывают межмолекулярные силы. Самая важная межмолекулярная сила для воды - водородная связь. Эти связи позволяют водородам одной молекулы взаимодействовать с кислородом другой.
Исследования показывают, что одна молекула воды может образовывать водородные связи с двумя другими
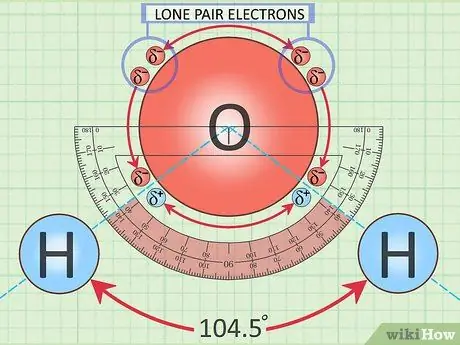
Шаг 3. Изучите изогнутую структуру одиночной молекулы воды
Каждое химическое вещество имеет определенную геометрическую форму. Вода здесь не исключение. Каждая молекула воды имеет так называемую изогнутую структуру. Два атома водорода расположены ближе, чем на 180 градусов друг к другу, потому что у кислорода есть дополнительные электроны, которые меняют форму.
Эти несвязанные электроны известны как «электроны неподеленной пары»
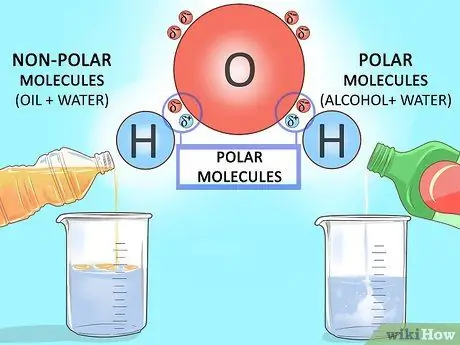
Шаг 4. Прочтите о полярных растворителях
Поскольку кислород удерживает электроны более эффективно, чем водород, они распределяются неравномерно. Это создает отрицательный конец (у кислорода) и положительный конец (у водорода) на молекуле воды. Молекулы с положительным и отрицательным полюсами известны как полярные молекулы, и они хорошо взаимодействуют с другими полярными молекулами. Вот почему вода является отличным растворителем для спирта (полярной жидкости), но плохим растворителем для растительного масла (неполярной жидкости).

Шаг 5. Освежите в памяти кислотно-щелочную химию
Вода амфотерная. Это означает, что это может быть кислота или основание и будет действовать по-разному в зависимости от окружающей среды. В кислой среде вода проявляет основные свойства (принимает протоны). В основной среде вода действует как кислота (отдает протоны).
Метод 2 из 3: распознавание уникальных свойств воды
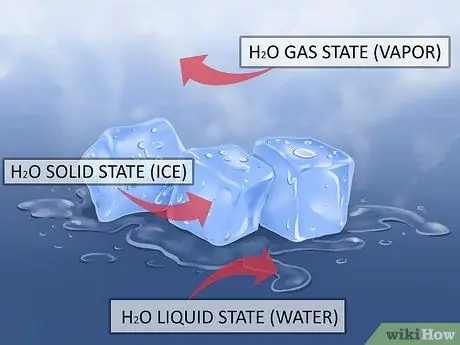
Шаг 1. Знайте, что вода может быть в трех естественных состояниях
Вода - единственное известное соединение, которое может быть найдено в твердом, жидком и газообразном состоянии в естественных условиях Земли. Это позволяет циркулировать воде вокруг нашей планеты посредством круговорота воды. Жидкая вода может испаряться и подниматься, водяной пар может конденсироваться и падать обратно на землю, а вода накапливается в виде льда в самых холодных частях нашей планеты (полярные ледяные шапки).
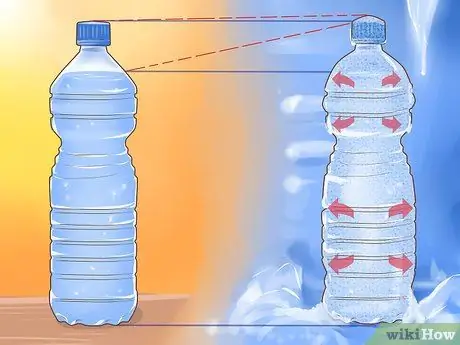
Шаг 2. Рассмотрим расширение льда
Большинство жидкостей становятся более плотными (их объем уменьшается), когда они замерзают в твердой форме. Вода - исключение. Когда вода замерзает, она расширяется. Это позволяет замороженной воде (льду) плавать поверх жидкой воды.
Вот почему бутылка с водой (или другой напиток, в основном состоящий из воды) часто лопается, если оставить ее в морозильной камере

Шаг 3. Ознакомьтесь с основными свойствами жидкости
В твердом состоянии вода имеет фиксированную кристаллическую форму. Однако чаще всего мы думаем о воде в ее жидкой форме. Жидкости (жидкости и газы) не имеют определенной формы и будут соответствовать форме своего сосуда. Основное различие между формой жидкости и газа заключается в том, что газы расширяются, заполняя весь контейнер, а жидкости удерживаются вместе за счет межмолекулярных сил.
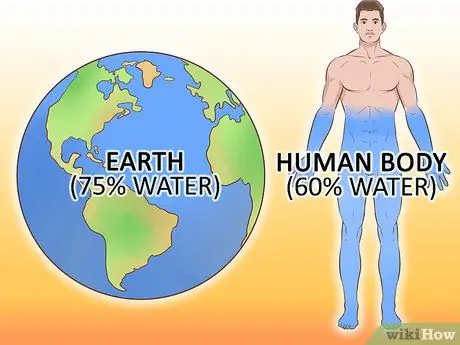
Шаг 4. Не стоит недооценивать важность воды для жизни, какой мы ее знаем
Примерно семьдесят процентов земли покрыто водой. Вода составляет более половины человеческого тела, а некоторые организмы на девяносто процентов состоят из воды. Нет никаких известных организмов, которые могли бы выжить без воды.
Метод 3 из 3: Проведение основных экспериментов с водой

Шаг 1. Продемонстрируйте полярность воды
Поскольку молекулы воды имеют положительный и отрицательный конец, они считаются полярными. Вы можете показать эту полярность, перемещая магнит (или другой источник электромагнитного поля) в сторону воды, текущей из крана. Вода будет изгибаться под действием магнита, потому что заряженные концы воды будут отталкиваться от магнитного поля или наклоняться к нему.
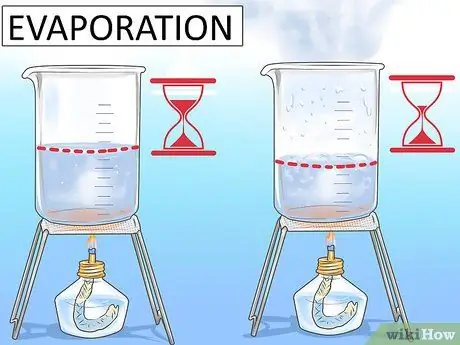
Шаг 2. Выпарить воду из посуды
Наполните чашку или блюдо почти полной водой. Отметьте уровень воды, чтобы запомнить, с каким количеством воды вы начинаете. Поставьте воду перед солнечным окном и оставьте на несколько часов. Периодически возвращайтесь и проверяйте уровень воды. Каждый раз отмечайте новый уровень.
Вы заметите, что вода становится все ниже и ниже. Это потому, что часть воды становится достаточно теплой, чтобы уйти в виде водяного пара. Это называется испарением

Шаг 3. Сконденсируйте воду на поверхности
Налейте в чашку горячую воду и накройте чашку крышкой. Положите на крышку кубик льда. По мере испарения горячей воды пар контактирует с холодной крышкой и конденсируется. Это позволит образовывать маленькие капельки воды на крышке.
Прозрачная или прозрачная крышка позволит вам лучше видеть капли
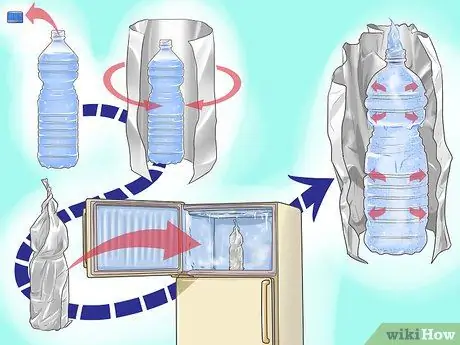
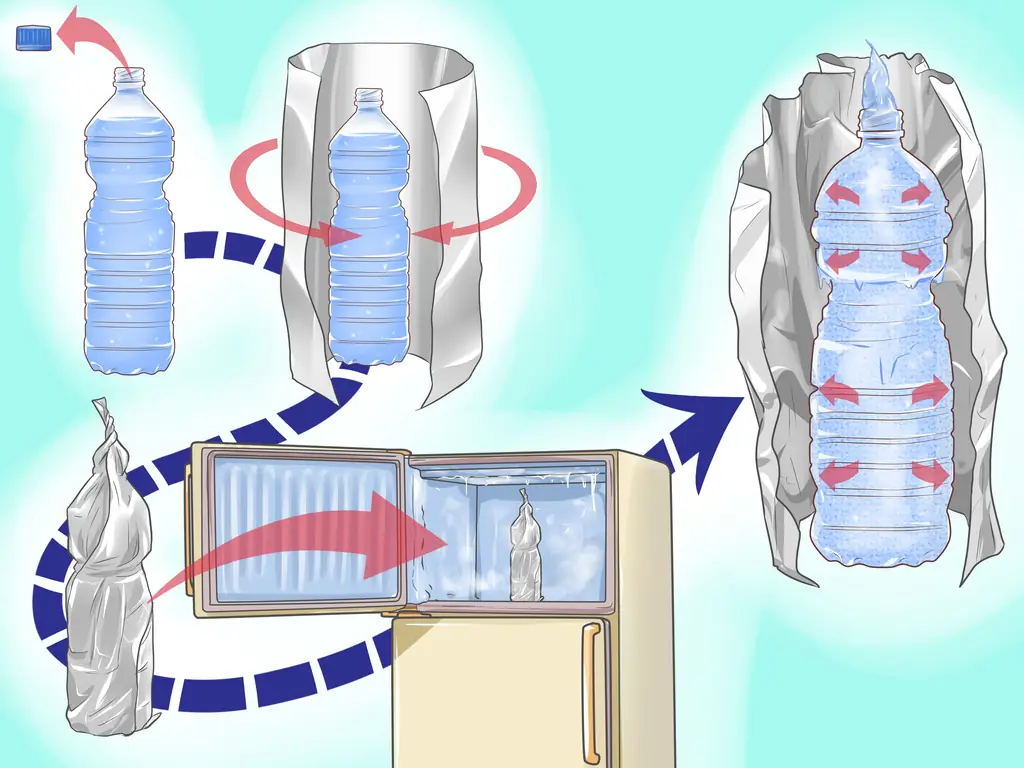
Шаг 4. Расширьте воду, заморозив ее
Наполните пластиковую бутылку водой. Накройте бутылку алюминиевой фольгой и осторожно поместите ее в морозильную камеру. Когда вода замерзнет, достаньте бутылку и посмотрите на результат.
- Вы заметите, что вода расширилась и вылилась из бутылки, также замерзая на фольге.
- Избегайте использования крышки. Это может привести к тому, что вода в бутылке при замерзании лопнет.