Аммиак входит в число наиболее производимых химических веществ в мире. Соединение легко синтезируется и используется для различных целей. Вы можете изучать аммиак и его реакции, читая об этом соединении или экспериментируя с ним в лаборатории, в зависимости от вашего химического образования и доступа к оборудованию. Вы обнаружите, что аммиак может реагировать разными способами, и даже синтез соединения требует подготовки.
Шаги
Метод 1 из 3: изучение конкретных реакций и использования аммиака

Шаг 1. Изучите использование аммиака в сельском хозяйстве
Азот необходим для роста растений. Вы можете добавить аммиак в почву, где он метаболизируется бактериями. Получаемые соединения представляют собой нитриты (NO2) и нитратов (NO3). Эти соединения могут легко использоваться растениями для роста.
Чтобы узнать больше о количестве аммиака в вашей почве, извлеките азотные соединения из почвы в лабораторных условиях. Поместите образец в духовку (~ 850 ° C (1, 560 ° F)) и добавьте много кислорода. При этой температуре соединения азота воспламеняются, что приводит к образованию газообразных оксидов азота (NOИкс). Газы можно собирать для анализа, а количество азота в образце почвы можно определить по объему NO.Икс присутствуют газы.

Шаг 2. Ознакомьтесь с названными реакциями аммиака
Аммиак имеет много применений, и некоторые из наиболее специфических реакций названы. Синтез азотной кислоты называется процессом Оствальда и включает в себя объединение аммиака с избыточным кислородом в условиях, при которых образуется диоксид азота. Нет2 затем пропускается через воду, которая поглощает газ и превращает его в азотную кислоту.
- В процессе Solvay углекислый газ пропускается через раствор соленой воды и аммиака с образованием карбоната натрия (кальцинированной соды).
- Список можно продолжить, и эти конкретные реакции получили свои собственные названия, потому что они удовлетворяли определенную потребность с использованием соединения аммиака.

Шаг 3. Рассмотрим, как аммиак влияет на брожение
Во время ферментации вина аммиак существует в форме иона аммония (NH4+). Это соединение используется дрожжами для производства аминокислот и других клеточных материалов. Без азота дрожжи не смогли бы воспроизвести и преобразовать сахар из винограда в этанол.
Метод 2 из 3: Понимание общей реакционной способности аммиака

Шаг 1. Узнайте, как действует аммиак в воде
В воде аммиак действует как акцептор протонов или основание Льюиса. Это означает, что он легко забирает молекулу водорода из воды с образованием NH.3+. При этом образуются молекулы ОН и повышается pH раствора.
Высокая растворимость аммиака может быть продемонстрирована экспериментально, перевернув трубку с газообразным аммиаком в воде вверх дном. Когда аммиак растворяется в воде, уровень воды в трубке повышается

Шаг 2. Узнайте о стабильности молекулы аммиака
Аммиак стабилен в большинстве условий. Он может терпеть воздействие света или тепла. Хотя аммиак является едким веществом, он не разъедает низкоуглеродистую или нержавеющую сталь или стекло, но он может повредить оцинкованную сталь, медь, цинк и некоторые другие металлы.
Аммиак может образовывать взрывоопасные соединения с некоторыми металлами. По этой причине нельзя подвергать серебро и ртуть воздействию аммиака

Шаг 3. Рассмотрим аммиак в щелочных или кислых условиях
Аммиак легко реагирует с кислотами с образованием солей. Сюда входят сильные кислоты, слабые кислоты и кислоты Льюиса (доноры протонов). Из-за своей способности вступать в реакцию с кислотами аммиак не допускает попадания сильнокислых растворов. Тем не менее, он растворяет некоторые основы для создания сильно основных растворов.
- Сульфат аммония легко сделать в лаборатории. Смешайте серную кислоту и нашатырный спирт, осторожно вскипятите и вылейте в емкость для выпаривания. По мере испарения воды кристаллы сульфата аммония осаждаются на чашке для испарения.
- Серная кислота очень агрессивна. Надевайте очки, перчатки и защитную одежду. Не вдыхайте пары серной кислоты или аммиака.

Шаг 4. Изучите реакции аммиака с галогенами
Аммиак очень бурно реагирует на галогены. Это приводит к реакции, называемой аммонолизом. В этих реакциях по крайней мере один из атомов водорода в аммиаке заменяется атомом другого типа. Хотя аммонолиз очень распространен между аммиаком и галогенами, он не ограничивается галогенами. Другие соединения также могут заменять водород.
Вы можете наблюдать безопасную версию этого, смочив ватный тампон в аммиаке, а второй ватный диск - в хлористом водороде. Поместите тампон в противоположные концы стеклянной трубки и дождитесь появления кольца белого порошка. Этот порошок - хлорид аммония
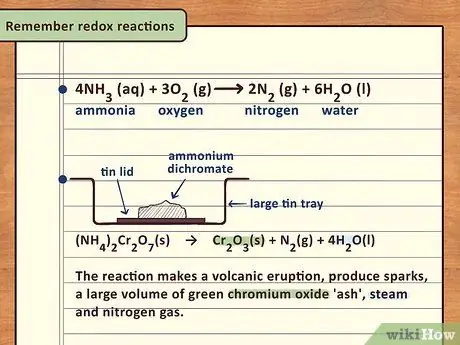
Шаг 5. Запомните окислительно-восстановительные реакции
Окислительно-восстановительные (или окислительно-восстановительные) реакции также происходят с аммиаком. В частности, аммиак будет гореть в присутствии газообразного кислорода с образованием H2O и N2 (газообразный азот). Аммиак также можно использовать для снижения окисления горячих металлов, таких как оксид меди, до неокисленного (или менее) состояния.
Чтобы продемонстрировать способность аммиака к окислительно-восстановительным реакциям, вы можете зажечь дихромат аммония (VI) и наблюдать за реакцией. Будьте осторожны, делая это в вытяжном шкафу на жаропрочной поверхности
Метод 3 из 3: Понимание синтеза аммиака
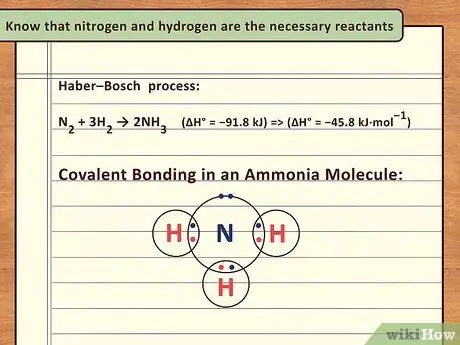
Шаг 1. Знайте, что азот и водород являются необходимыми реагентами
Рассмотрим химическое уравнение аммиака NH3. Из этого уравнения можно сказать, что одна молекула азота должна соединиться с 3 молекулами водорода, чтобы образовать соединение. Этот процесс начинается с введения в химический реактор с катализатором отношения 3 водорода к 1 азоту.

Шаг 2. Поймите, что катализатор необходим для ускорения реакции
Прежде всего следует знать, что катализатор не вступает в прямую реакцию с реагентами. Думайте об этом как о способе ускорить реакцию, которая все равно произойдет. Катализатором образования аммиака является соединение железа, содержащее гидроксид калия.
Следует отметить, что использование катализатора только ускорит скорость реакции и не увеличит общий процент аммиака, который в итоге образуется

Шаг 3. Рассмотрим влияние тепла на реакцию синтеза
Поймите, что температура - это палка о двух концах при производстве аммиака. Вы можете снизить температуру, чтобы получить наилучшее преобразование азота и водорода в NH.3. Обратной стороной является то, что, понижая температуру, вы также замедляете реакцию. Большинство производителей аммиака используют температуру 400-450 ° C (752-842 ° F).
Принцип Ле Шателье определяет, как тепло влияет на переход N и H в NH.3.

Шаг 4. Подумайте, как давление изменит реакцию
Вы также можете изменить преобразование N и H в NH.3 при перепадах давления. Если вы используете более высокое давление, вы сблизите молекулы и ускорит реакцию с образованием аммиака. Большинство производителей используют умеренно высокое давление около 200 атмосфер.
Создание чрезвычайно высокого давления обходится дорого (вы должны покупать оборудование для создания давления и его сдерживания), поэтому часто ищут компромисс для получения аммиака экономичным способом

Шаг 5. Изучите технологию экстракции полученного аммиака
После того, как вы успешно произведете аммиак, он будет среди других газов (в частности, газообразного азота и газообразного водорода) при высокой температуре и давлении. К счастью, сжижать аммиак легче, чем азот или водород. Вы должны охладить газы примерно до -34,4 ° C (-29,9 ° F), чтобы аммиак выпал в осадок в виде жидкости.
Оставшиеся газы рециркулируют через реакционную камеру, чтобы произвести больше аммиака
подсказки
Аммиак находит бесчисленное множество применений, включая альтернативную энергию, очистку, использование в охлаждении, синтез многих соединений и т. Д
Предупреждения
- Аммиак очень токсичен.
- Получите паспорта безопасности материалов для любых используемых вами химикатов и соблюдайте все меры предосторожности.
