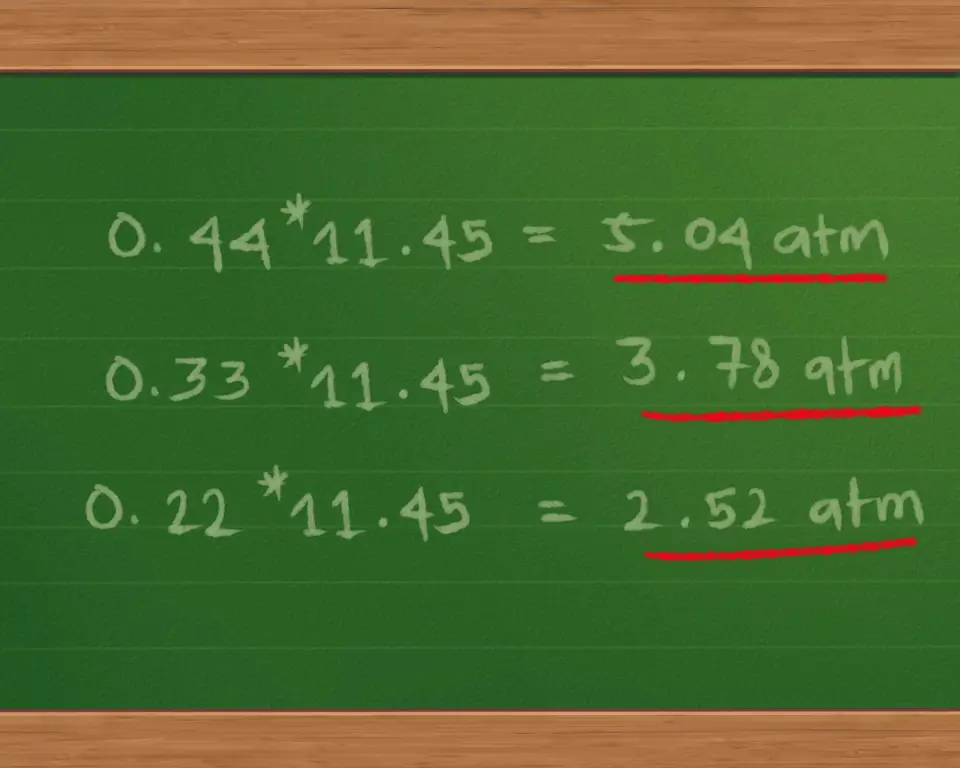В химии «парциальное давление» относится к давлению, которое каждый газ в газовой смеси оказывает на окружающую среду, такую как колба для образца, воздушный баллон водолаза или граница атмосферы. Вы можете рассчитать давление каждого газа в смеси, если знаете, сколько его имеется, какой объем он занимает и его температуру. Затем вы можете сложить эти парциальные давления вместе, чтобы найти полное давление газовой смеси, или вы можете сначала найти общее давление, а затем найти парциальные давления.
Шаги
Часть 1 из 3: Понимание свойств газов

Шаг 1. Рассматривайте каждый газ как «идеальный» газ
В химии идеальный газ - это газ, который взаимодействует с другими газами, не притягиваясь к их молекулам. Отдельные молекулы могут сталкиваться друг с другом и отскакивать, как бильярдные шары, без какой-либо деформации.
- Давление идеальных газов увеличивается, когда они сжимаются в меньшие пространства, и уменьшаются, когда они расширяются на большие площади. Эти отношения называются законом Бойля в честь Роберта Бойля. Математически это записывается как k = P x V или, проще говоря, k = PV, где k представляет постоянное соотношение, P представляет давление, а V представляет объем.
- Давление может быть задано с использованием одной из нескольких возможных единиц. Один из них - паскаль (Па), определяемый как сила в один ньютон, приложенная к квадратному метру. Другой - атмосфера (атм), определяемая как давление атмосферы Земли на уровне моря. Давление 1 атм равно 101 325 Па.
- Температуры идеальных газов увеличиваются при увеличении их объемов и уменьшаются при уменьшении их объемов. Эти отношения называются законом Карла в честь Жака Шарля. Математически это записывается как k = V / T, где k представляет постоянное соотношение между объемом и температурой, V снова представляет объем, а T представляет температуру.
- Температуры газов в этом уравнении даны в градусах Кельвина, которые находятся путем прибавления 273 к числу градусов Цельсия в температуре газа.
- Эти два отношения можно объединить в одно уравнение: k = PV / T, которое также можно записать как PV = kT.

Шаг 2. Определите количества, в которых измеряются газы
У газов есть масса и объем. Объем обычно измеряется в литрах (л), но есть два вида массы.
- Обычная масса измеряется в граммах или, если масса достаточно большая, в килограммах.
- Из-за того, что газы обычно легкие, они также измеряются с помощью другой формы массы, называемой молекулярной массой или молярной массой. Молярная масса определяется как сумма атомных масс каждого атома в соединении, из которого состоит газ, при этом каждый атом сравнивается со стандартным значением 12 для молярной массы углерода.
- Поскольку атомы и молекулы слишком малы для работы, количество газов определяется в молях. Количество молей, присутствующих в данном газе, можно найти путем деления массы на молярную массу и может быть представлено буквой n.
- Мы можем заменить произвольную константу k в уравнении газа произведением n, числа молей (моль) и новой константы R. Теперь уравнение можно записать nR = PV / T или PV = nRT.
- Значение R зависит от единиц измерения давления, объема и температуры газов. Для объема в литрах, температуры в градусах Кельвина и давления в атмосферах его значение составляет 0,0821 л атм / К моль. Это также можно записать 0,0821 Л атм К-1 моль -1 чтобы избежать использования разделительной косой черты с единицами измерения.

Шаг 3. Понять закон частичных давлений Дальтона
Закон Дальтона, разработанный химиком и физиком Джоном Дальтоном, который первым выдвинул идею о том, что химические элементы состоят из атомов, гласит, что полное давление газовой смеси является суммой давлений каждого из газов в смеси.
- Закон Дальтона можно записать в форме уравнения как Pобщий = P1 + P2 + P3 … С таким количеством слагаемых после знака равенства, сколько газов в смеси.
- Уравнение закона Дальтона может быть расширено при работе с газами, индивидуальные парциальные давления которых неизвестны, но мы знаем их объем и температуру. Парциальное давление газа - это такое же давление, как если бы такое же количество этого газа было единственным газом в контейнере.
- Для каждого из парциальных давлений мы можем переписать уравнение идеального газа так, чтобы вместо PV = nRT мы могли иметь только P слева от знака равенства. Для этого разделим обе части на V: PV / V = nRT / V. Две буквы V на левой стороне уравновешиваются, в результате остается P = nRT / V.
- Затем мы можем заменить каждый индекс P в правой части уравнения парциальных давлений: Pобщий = (nRT / V) 1 + (nRT / V) 2 + (nRT / V) 3 …
Часть 2 из 3: Расчет частичного, затем полного давления
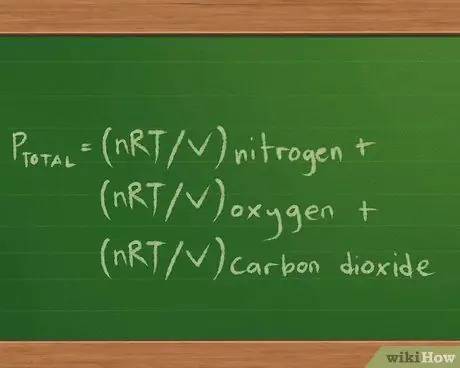
Шаг 1. Составьте уравнение парциального давления для газов, с которыми вы работаете
Для целей этого расчета мы предположим, что 2-литровая колба вмещает 3 газа: азот (N2), кислород (O2) и диоксид углерода (CO2). Каждого газа по 10 г, и температура каждого газа в колбе составляет 37 градусов по Цельсию (98,6 градусов по Фаренгейту). Нам нужно найти парциальное давление для каждого газа и общее давление, которое газовая смесь оказывает в баллоне.
- Наше уравнение парциального давления становится Pобщий = Pазот + Pкислород + Pуглекислый газ.
- Поскольку мы пытаемся найти давление, которое оказывает каждый газ, мы знаем объем и температуру, и мы можем определить, сколько молей каждого газа присутствует в зависимости от массы, мы можем переписать это уравнение как: Pобщий = (nRT / V) азот + (nRT / V) кислород + (nRT / V) углекислый газ

Шаг 2. Преобразуйте температуру в градусы Кельвина
Температура по Цельсию составляет 37 градусов, поэтому мы прибавляем 273 к 37, чтобы получить 310 градусов К.

Шаг 3. Найдите количество молей каждого газа, присутствующего в пробе
Число молей газа - это масса этого газа, деленная на его молярную массу, которая, как мы сказали, является суммой атомных масс каждого атома в соединении.
- Для нашего первого газа азот (N2), каждый атом имеет атомный вес 14. Поскольку азот двухатомный (образует двухатомные молекулы), мы должны умножить 14 на 2, чтобы найти, что азот в нашем образце имеет молярную массу 28. Затем мы разделим массу в граммах, 10 г, умножить на 28, чтобы получить количество молей, которое при округлении до десятых мы округлим до 0,4 моля азота.
- Для нашего второго газа кислород (O2), каждый атом имеет атомный вес 16. Кислород также двухатомный, поэтому мы умножаем 16 на 2 и получаем, что кислород в нашем образце имеет молярную массу 32. Разделив 10 г на 32, мы получим примерно 0,3 моля кислорода в нашем образце. образец.
- Наш третий газ - углекислый газ (CO2), имеет 3 атома: один углеродный с атомной массой 12; и два кислорода, каждый с атомным весом 16. Мы складываем три веса: 12 + 16 + 16 = 44 как молярная масса. Разделив 10 г на 44, мы получим примерно 0,2 моль диоксида углерода.
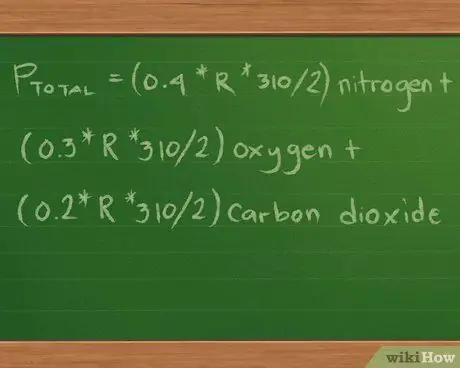
Шаг 4. Введите значения молей, объема и температуры
Наше уравнение теперь выглядит так: Pобщий = (0,4 * R * 310/2) азот + (0,3 * R * 310/2) кислород + (0,2 * R * 310/2) углекислый газ.
Для простоты мы исключили единицы измерения, сопровождающие значения. Эти единицы будут отменены после того, как мы выполним математические вычисления, оставив только ту единицу измерения, которую мы используем для представления данных о давлении
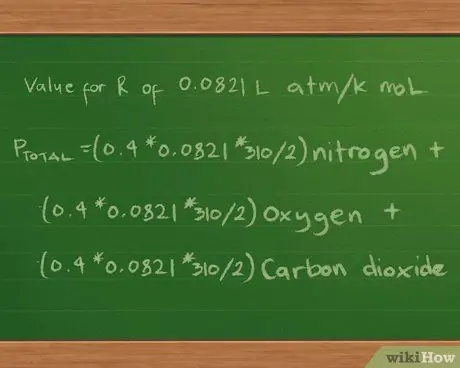
Шаг 5. Подставьте значение константы R
Мы укажем парциальное и полное давление в атмосферах, поэтому мы будем использовать значение R, равное 0,0821 л атм / К моль. Подставив это значение в уравнение, мы получим Pобщий =(0.4 * 0.0821 * 310/2) азот + (0.3 *0.0821 * 310/2) кислород + (0.2 * 0.0821 * 310/2) углекислый газ.

Шаг 6. Рассчитайте парциальные давления для каждого газа
Теперь, когда у нас есть значения, пора заняться математикой.
- Для парциального давления азота мы умножаем 0,4 моль на нашу постоянную 0,0821 и нашу температуру 310 градусов К, а затем делим на 2 литра: примерно 0,4 * 0,0821 * 310/2 = 5,09 атм.
- Для парциального давления кислорода мы умножаем 0,3 моль на нашу постоянную 0,0821 и нашу температуру 310 градусов К, а затем делим на 2 литра: примерно 0,3 * 0,0821 * 310/2 = 3,82 атм.
- Для парциального давления углекислого газа мы умножаем 0,2 моль на нашу постоянную 0,0821 и нашу температуру 310 градусов К, а затем делим на 2 литра: 0,2 * 0,0821 * 310/2 = 2,54 атм, приблизительно.
- Теперь сложим эти давления, чтобы найти полное давление: Pобщий = 5,09 + 3,82 + 2,54, или 11,45 атм, приблизительно.
Часть 3 из 3: Расчет общего, затем парциального давления
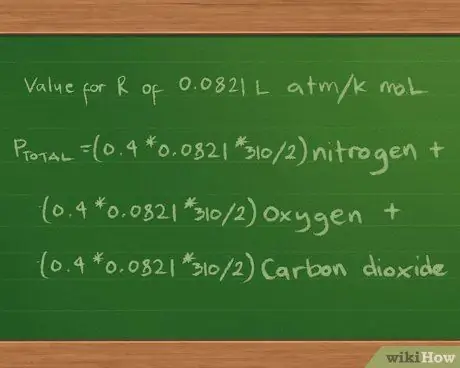
Шаг 1. Определите уравнение парциального давления, как и раньше
Опять же, предположим, что 2-литровая колба содержит 3 газа: азот (N2), кислород (O2) и диоксид углерода (CO2). Каждого газа по 10 г, и температура каждого газа в колбе составляет 37 градусов по Цельсию (98,6 градусов по Фаренгейту).
- Температура Кельвина по-прежнему будет 310 градусов, и, как и прежде, у нас будет примерно 0,4 моль азота, 0,3 моль кислорода и 0,2 моль диоксида углерода.
- Точно так же мы по-прежнему будем сообщать о давлении в атмосферах, поэтому мы будем использовать значение 0,0821 л атм / К моль в качестве константы R.
- Таким образом, наше уравнение парциальных давлений на этом этапе все еще выглядит так же: Pобщий =(0.4 * 0.0821 * 310/2) азот + (0.3 *0.0821 * 310/2) кислород + (0.2 * 0.0821 * 310/2) углекислый газ.
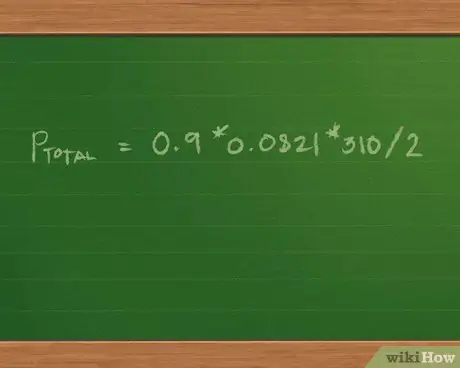
Шаг 2. Сложите количество молей каждого газа в образце, чтобы найти общее количество молей в газовой смеси
Поскольку объем и температура одинаковы для каждого образца в газе, не говоря уже о том, что каждое молярное значение умножается на одну и ту же константу, мы можем использовать распределительное свойство математики, чтобы переписать уравнение как Pобщий = (0.4 + 0.3 + 0.2) * 0.0821 * 310/2.
Добавление 0,4 + 0,3 + 0,2 = 0,9 моль газовой смеси. Это еще больше упрощает уравнение до Pобщий = 0.9 * 0.0821 * 310/2.
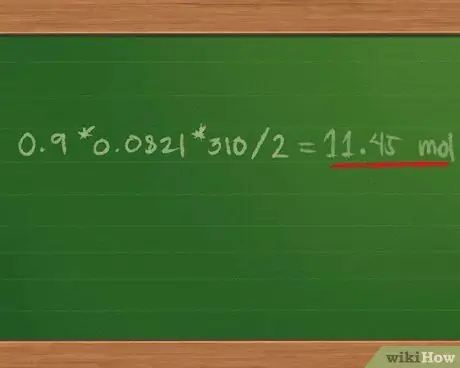
Шаг 3. Найдите полное давление газовой смеси
Умножив 0,9 * 0,0821 * 310/2 = 11,45 моль, приблизительно.

Шаг 4. Найдите долю каждого газа в общей смеси
Для этого разделите количество молей каждого газа на общее количество молей.
- Здесь 0,4 моль азота, поэтому 0,4 / 0,9 = 0,44 (44 процента) образца, приблизительно.
- Азот составляет 0,3 моль, поэтому примерно 0,3 / 0,9 = 0,33 (33 процента) образца.
- Здесь 0,2 моль диоксида углерода, поэтому 0,2 / 0,9 = 0,22 (22 процента) образца примерно.
- В то время как приведенные выше приблизительные проценты в сумме составляют всего 0,99, фактические десятичные дроби повторяются, поэтому сумма будет представлять собой повторяющуюся серию из 9 секунд после десятичной дроби. По определению это то же самое, что 1 или 100 процентов.

Шаг 5. Умножьте пропорциональное количество каждого газа на общее давление, чтобы найти парциальное давление
- Умножая 0,44 * 11,45 = 5,04 атм, приблизительно.
- Умножая 0,33 * 11,45 = 3,78 атм, приблизительно.
- Умножая 0,22 * 11,45 = 2,52 атм, приблизительно.