Молекулярная формула - важная информация для любого химического соединения. Молекулярная формула сообщает вам, какие атомы присутствуют в соединении и сколько из них присутствует. Вам нужно будет знать эмпирическую формулу для вычисления молекулярной формулы, и вам нужно будет знать, что разница между этими двумя формулами - это множитель целого числа.
Шаги
Часть 1 из 3: Получение молекулярной формулы из эмпирической формулы
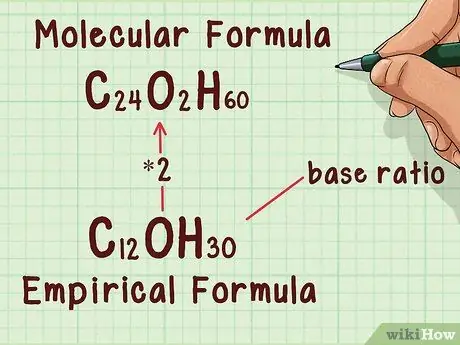
Шаг 1. Знать взаимосвязь между молекулярными и эмпирическими формулами
Эмпирическая формула обеспечивает простейшее, наиболее низкое соотношение элементов в молекуле, например, два атома кислорода на каждый углерод. Молекулярная формула говорит вам, сколько из этих атомов присутствует в молекуле. Например, один углерод и два атома кислорода (углекислый газ). Две формулы связаны целочисленным соотношением, так что если эмпирическую формулу умножить на соотношение, получится молекулярная формула.

Шаг 2. Подсчитайте количество молей газа
Это означает использование закона идеального газа. Вы можете определить количество молей на основе давления, объема и температуры, предоставленных экспериментальными данными. Количество родинок можно рассчитать по следующей формуле: n = PV / RT.
-
В этой формуле
это количество родинок, п давление, V объем, Т это температура в Кельвинах, а р - газовая постоянная. - Пример: n = PV / RT = (0,984 атм. * 1 л) / (0,08206 л атм. Моль-1 K-1 * 318,15 K) = 0,0377 моль.
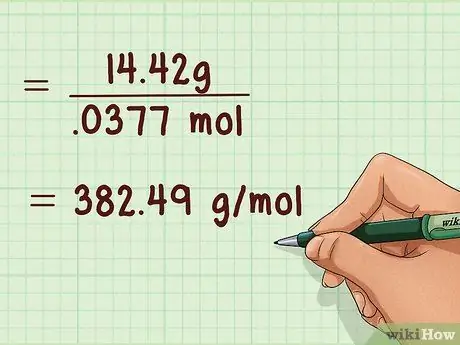
Шаг 3. Рассчитайте молекулярную массу газа
Это можно сделать только после определения количества присутствующих молей газа с помощью закона идеального газа. Вам также необходимо знать, сколько граммов газа присутствовало. Затем разделите граммы газа на количество присутствующего газа в молях, чтобы получить молекулярную массу.
Пример: 14,42 г / 0,0377 моль = 382,49 г / моль

Шаг 4. Сложите атомные веса всех атомов в эмпирической формуле
Каждый атом в эмпирической формуле имеет свой атомный вес. Это значение можно найти в нижней части квадрата атома в периодической таблице. Сложите эти веса вместе, чтобы получить вес эмпирической формулы.
- Например, углерод имеет атомный вес 12,0107, водород имеет атомный вес 1,00794, а кислород имеет атомный вес 15,9994. Можно посмотреть атомный вес, если вы его не знаете.
- Пример: (12,0107 г * 12) + (15,9994 г * 1) + (1,00794 г * 30) = 144,1284 + 15,9994 + 30,2382 = 190,366 г.

Шаг 5. Найдите соотношение между молекулярной массой и массой, полученной по эмпирической формуле
При этом вы можете определить, сколько раз эмпирический вес повторяется в реальной молекуле. Зная, сколько раз повторяется эмпирический вес, вы сможете найти, сколько раз эмпирическая формула повторяется в молекулярной формуле. Это должно быть целое число. Если соотношение не является целым числом, вам придется его округлить.
Пример: 382,49 / 190,366 = 2,009
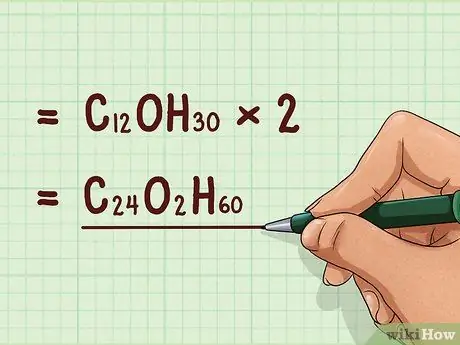
Шаг 6. Умножьте эмпирическую формулу на коэффициент
Умножьте индексы эмпирической формулы на соотношение. Это даст молекулярную формулу. Обратите внимание, что для любого соединения с соотношением «1» эмпирическая формула и молекулярная формула будут одинаковыми.
Пример: C12OH30 * 2 = C24O2H60
Часть 2 из 3: поиск эмпирической формулы
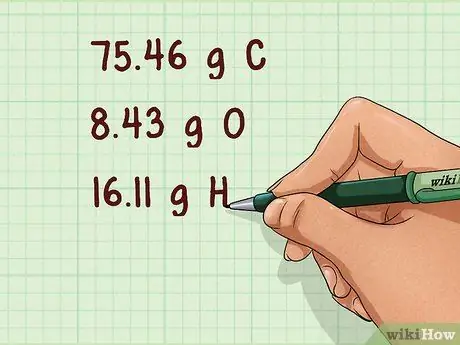
Шаг 1. Найдите массу каждого присутствующего атома
Иногда будет дана масса каждого атома. В других случаях это будет выражено в процентах по массе. В этом случае предположим, что образец соединения составляет 100 г. Это позволит вам записать процент массы как фактическую массу в граммах.
Пример: 75,46 г C, 8,43 г O, 16,11 г H
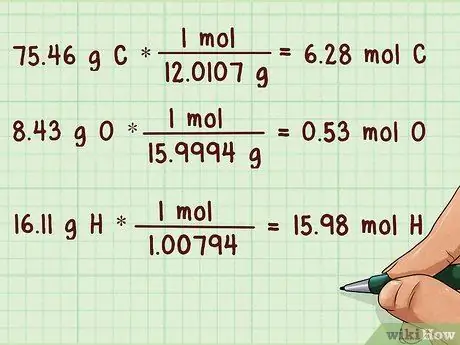
Шаг 2. Преобразуйте массы в родинки
Вам нужно преобразовать молекулярные массы каждого элемента в моли. Для этого вам нужно разделить молекулярные массы на атомные массы каждого соответствующего элемента. Вы можете найти атомную массу в нижней части квадрата этого элемента в периодической таблице.
-
Пример:
- 75,46 г C * (1 моль / 12,0107 г) = 6,28 моль C
- 8,43 г O * (1 моль / 15,9994 г) = 0,53 моль O
- 16,11 г H * (1 моль / 1,00794) = 15,98 моль H

Шаг 3. Разделите все молярные значения на наименьшее молярное значение
Вам нужно разделить количество молей для каждого отдельного элемента на наименьшее молярное количество всех элементов, присутствующих в соединении. Поступая таким образом, вы можете найти простейшие мольные отношения. Это работает, потому что задает для наименее распространенного элемента значение «1» и обеспечивает соответствующие соотношения других элементов в соединении.
-
Пример: Наименьшее молярное количество кислорода - 0,53 моль.
- 6,28 моль / 0,53 моль = 11,83
- 0,53 моль / 0,53 моль = 1
- 15,98 моль / 0,53 моль = 30,15
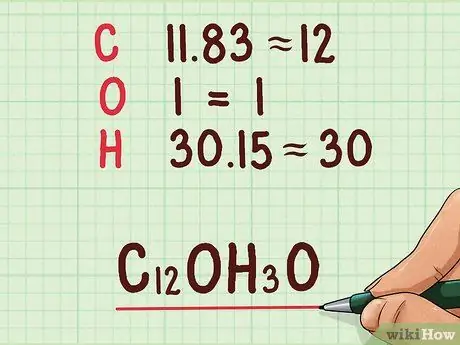
Шаг 4. Округлите молярные значения до целых чисел
Эти числа станут индексами в эмпирической формуле. Их следует округлить до ближайшего целого числа. Найдя эти числа, вы можете написать эмпирическую формулу.
-
Пример: эмпирическая формула будет: C12OH30.
- 11.83 = 12
- 1 = 1
- 30.15 = 30
Часть 3 из 3: Понимание химических формул

Шаг 1. Разберитесь с эмпирической формулой
Эмпирическая формула дает вам информацию о молярных отношениях одного атома к другому в молекуле. Это не дает никакой информации о том, сколько именно атомов присутствует в молекуле. Эмпирическая формула также не может предоставить информацию о структуре и связях атомов в молекуле.

Шаг 2. Узнайте, что вам говорит молекулярная формула
Как и эмпирическая формула, молекулярная формула не может предоставить информацию о связи и структуре молекулы. В отличие от эмпирической формулы, молекулярная формула дает вам подробную информацию о том, сколько атомов каждого атома присутствует в молекуле. Эмпирическая формула и молекулярная формула связаны целочисленным соотношением.

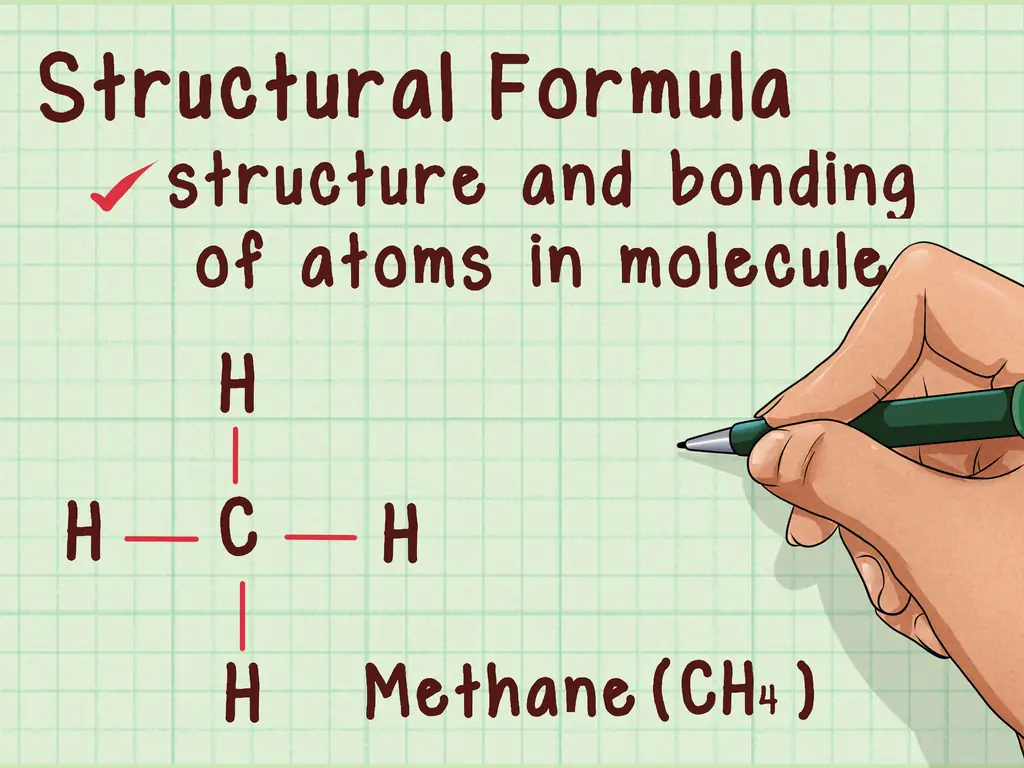
Шаг 3. Изучите структурные представления
Структурные представления дают даже больше информации, чем молекулярные формулы. Помимо отображения количества каждого атома в молекуле, структурные представления дают вам информацию о связи и структуре молекулы. Эта информация имеет решающее значение для понимания реакции молекулы.
Есть несколько различных типов структурных представлений, которые показывают вам разные вещи о соединении. Например, он может показать связность соединения или его молекулярную форму, например, путем рисования пунктирных линий для обозначения их связей
подсказки
- Внимательно прочтите проблему (или данные).
- Имейте в виду, что наименьшее количество атомов в молекуле для некоторых элементов может не равняться 1. Например, соотношение может быть 1,333, что в виде дроби составляет 4/3. Чтобы избавиться от дроби, вы можете умножить ее на знаменатель, в данном случае на 3.