Средняя атомная масса не является прямым измерением отдельного атома. Вместо этого это средняя масса на атом для типичного образца данного элемента. Если бы вы могли измерить массу миллиардов отдельных атомов, вы могли бы вычислить это значение так же, как и любое среднее значение. К счастью, есть более практичный метод, основанный на записанной информации о редкости различных изотопов.
Шаги
Часть 1 из 2: Расчет средней атомной массы
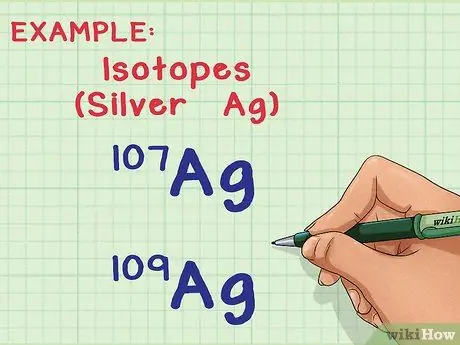
Шаг 1. Понять изотопы и атомные массы
Большинство элементов могут встречаться в природе в нескольких формах или изотопах. Массовое число каждого изотопа - это сумма количества протонов и нейтронов в ядре. Каждый протон и каждый нейтрон весят 1 атомную единицу массы (а.е.м.). Единственная разница между двумя изотопами одного и того же элемента - это количество нейтронов на атом, которое влияет на массу атома. Однако элемент всегда имеет одинаковое количество протонов.
- Средняя атомная масса элемента учитывает вариации количества нейтронов и сообщает вам среднюю массу на атом в типичном образце этого элемента.
- Например, элемент серебро (Ag) имеет два встречающихся в природе изотопа: Ag-107 и Ag-109 (или 107Ag и 109Ag). Изотопы названы в честь «массового числа» или суммы протонов и нейтронов в одном атоме. Это означает, что Ag-109 имеет на два нейтрона на атом больше, чем Ag-107, что придает ему немного большую массу.
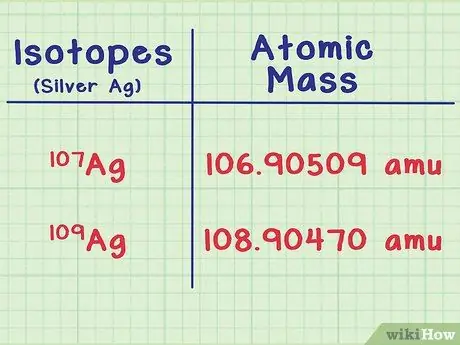
Шаг 2. Найдите массу каждого изотопа
Для каждого изотопа вам понадобятся две части информации, которую вы можете найти в справочнике или в онлайн-источнике, таком как webelements.com. Первый - это атомная масса или масса одного атома каждого изотопа. Изотопы с большим количеством нейтронов имеют большую массу.
- Например, изотоп серебра Ag-107 имеет атомную массу 106,90509 а.е.м. (атомные единицы массы). Изотоп Ag-109 немного тяжелее с массой 108.90470.
- Последняя пара десятичных знаков может немного отличаться в разных источниках. Не включайте числа в скобки после массы.

Шаг 3. Запишите содержание каждого изотопа
Обилие показывает, насколько распространен изотоп в процентах от всех атомов элемента. Каждый изотоп вносит свой вклад пропорционально своему распространению (чем больше изотоп, тем больше он вносит вклад в среднюю атомную массу). Вы можете найти это в том же источнике, в котором нашли массу. Содержание всех изотопов должно составлять в сумме 100% (хотя это может немного отличаться из-за ошибок округления).
- Изотоп Ag-107 имеет содержание 51,86%. Немного реже встречается Ag-109 с содержанием 48,14%. Это означает, что типичный образец серебра содержит 51,86% Ag-107 и 48,14% Ag-109.
- Игнорируйте любые изотопы, количество которых не указано в списке. Эти изотопы не встречаются в природе на Земле.

Шаг 4. Превратите проценты изобилия в десятичные дроби
Разделите процент содержания на 100, чтобы получить то же значение, что и десятичная дробь.
В задаче выборки численность составляет 51,86 / 100 = 0.5186 и 48,14 / 100 = 0.4814.

Шаг 5. Найдите средневзвешенное значение атомной массы его стабильных изотопов
Средняя атомная масса элемента с n изотопами равна (массаизотоп 1 * избытокизотоп 1) + (массаизотоп 2 * избытокизотоп 2) +… + (Массаизотоп n * избытокизотоп n . Это пример «средневзвешенного», означающего, что более общие (более многочисленные) образования имеют большее влияние на результат. Вот как использовать эту формулу для серебра:
-
Средняя атомная массаAg = (массаАг-107 * избытокАг-107) + (массаAg-109 * избытокAg-109)
=(106.90509 * 0.5186) + (108.90470 * 0.4814)
= 55.4410 + 52.4267
= 107,8677 а.е.м.
- Найдите элемент в таблице Менделеева, чтобы проверить свой ответ. Средняя атомная масса обычно указывается под символом элемента.
Часть 2 из 2: Использование результата
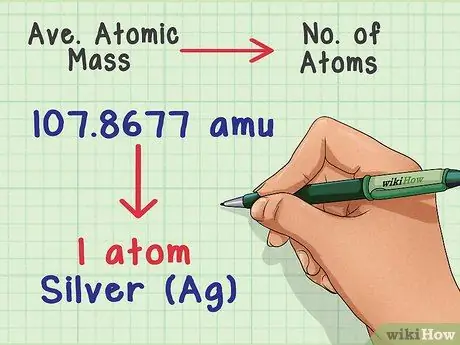
Шаг 1. Перевести массу в количество атомов
Средняя атомная масса показывает соотношение между массой и количеством атомов в типичном образце элемента. Это полезно в химических лабораториях, потому что почти невозможно подсчитать количество атомов напрямую, но легко измерить массу. Например, вы можете взвесить образец серебра и предсказать, что каждые 107,8677 а.е.м. массы содержат один атом серебра.

Шаг 2. Перевести в молярную массу
Атомные единицы массы очень малы, поэтому химики обычно взвешивают образцы в граммах. К счастью, эти концепции определены таким образом, чтобы сделать преобразование максимально простым. Просто умножьте среднюю атомную массу на 1 г / моль (константа молярной массы), чтобы вместо этого получить ответ в г / моль. Например, 107,8677 грамма серебра содержат в среднем один моль атомов серебра.

Шаг 3. Найдите среднюю молекулярную массу
Поскольку молекула - это просто набор атомов, вы можете сложить массы атомов вместе, чтобы найти массу молекулы. Если вы используете средние атомные массы (вместо массы определенного изотопа), ответом будет средняя масса молекулы, найденная в образце природного происхождения. Вот пример:
- Молекула воды имеет химическую формулу H2O, поэтому он содержит два атома водорода (H) и один атом кислорода (O).
- Средняя атомная масса водорода 1,00794 а.е.м. Атомы кислорода имеют среднюю массу 15,9994 а.е.м.
- Средняя масса молекулы H2O равно (1,00794) (2) + 15,9994 = 18,01528 а.е.м., что эквивалентно 18,01528 г / моль.
Видео - с помощью этой службы некоторая информация может быть передана YouTube
подсказки
- Термин относительная атомная масса иногда используется как синоним средней атомной массы. Есть небольшая разница, поскольку относительная атомная масса не имеет единиц; это мера массы относительно атома углерода-12. Однако до тех пор, пока вы используете атомные единицы массы при расчете средней массы, эти два значения численно идентичны.
- За редкими исключениями, элементы более поздней периодической таблицы имеют более высокую среднюю массу, чем элементы до нее. Это быстрый способ проверить, имеют ли ваши ответы смысл.
- 1 атомная единица массы определяется как 1/12 массы одного атома углерода-12.
- Содержание изотопов основано на образцах, встречающихся в природе на Земле. Необычные вещества, такие как метеорит или образец, созданный в лаборатории, могут иметь другое соотношение изотопов и, следовательно, другую среднюю атомную массу.
- Число в скобках после атомной массы указывает на погрешность последней цифры. Например, атомная масса 1,0173 (4) означает, что типичные образцы варьируются в пределах 1,0173 ± 0,0004. Вам не нужно принимать это во внимание, если этого не требует проблема.
- Используйте среднюю атомную массу при вычислении массы элементов и соединений.
