Атомы - это строительные блоки всей материи. Различные виды атомов называются «элементами», и они составляются в диаграмму, называемую периодической таблицей. Таблица позволяет сгруппировать похожие элементы на основе их химических свойств. Интересно, что атомы в одной и той же группе часто также имеют схожие физические свойства. Если вы хотите понять химические и физические свойства атомов, научитесь разделять периодическую таблицу на группы и изучать свойства каждой группы.
Шаги
Метод 1 из 3: разделение периодической таблицы
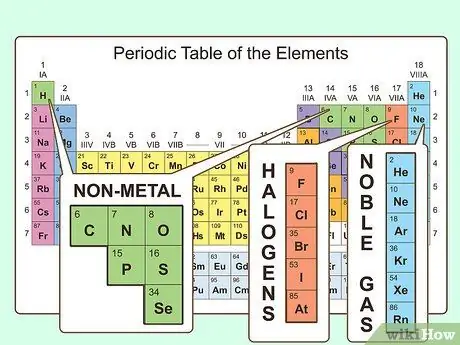
Шаг 1. Найдите элементы, не являющиеся металлами
В периодической таблице большинство атомов классифицируются как металлы. Остальные атомы классифицируются как неметаллы. Вы найдете эти группировки полезными, когда будете исследовать свойства различных атомов.
- Неметаллы можно найти в основном в правом верхнем углу таблицы Менделеева, в то время как остальная часть таблицы состоит в основном из металлов. Водород является исключением из этого правила, поскольку в стандартных условиях он действует как неметалл, но он находится в верхнем левом углу таблицы.
- Углерод, азот, кислород, водород, сера и благородные газы (элементы в крайнем правом столбце) являются широко известными неметаллами.
- Галогены (такие как фтор, хлор, бром и т. Д.) Относятся к категории неметаллов.
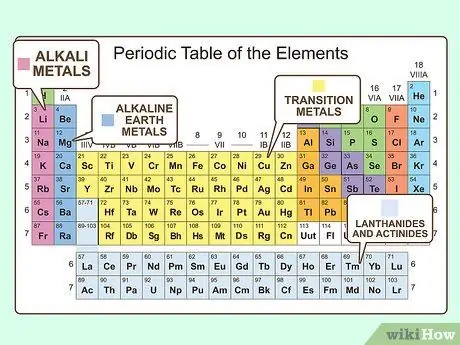
Шаг 2. Выделите основные группы металлов
Металлы сгруппированы по подкатегориям. Элементы в этих подкатегориях похожи более конкретными способами, чем просто идентифицируются как металлы. Общие категории - щелочные металлы, щелочноземельные металлы, переходные металлы, постпереходные металлы, лантаноиды и актиниды.
- Щелочные металлы очень реактивны и легко ионизируются до 1+ штат.
- Щелочноземельные металлы немного менее реактивны, но легко ионизируются до 2+ штат.
- Переходные и постпереходные металлы более стабильны и имеют много различных состояний ионизации.
- Лантаноиды и актиниды - более крупные и менее стабильные молекулы, которые легко вступают в реакцию. Некоторые из них разлагаются, делая их радиоактивными.
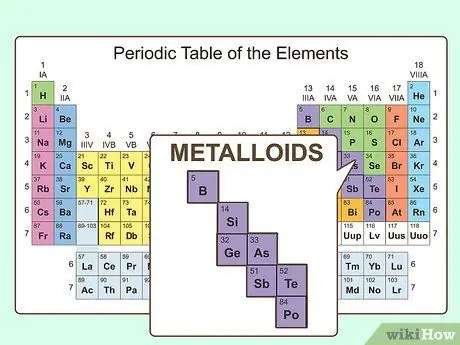
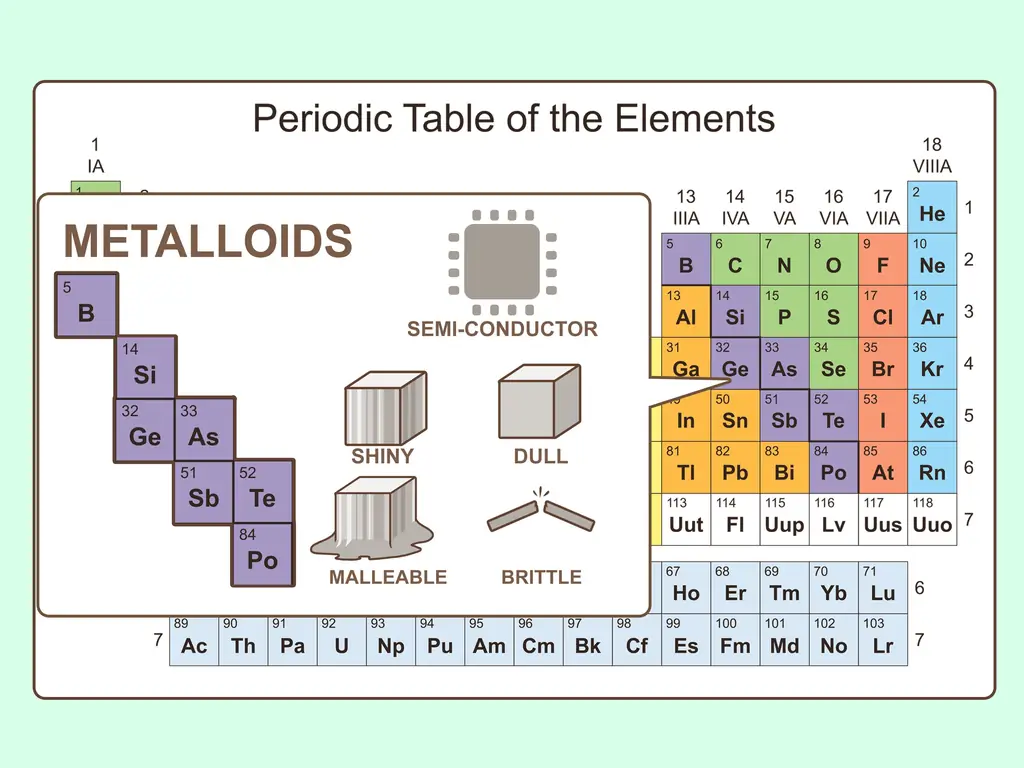
Шаг 3. Представьте себе что-то среднее между металлом и неметаллом
Такие элементы действительно существуют, и они известны как металлоиды. В периодической таблице металлоиды появляются между постпереходными металлами и неметаллами. Всего существует восемь металлоидов:
- Бор
- Кремний
- Германий
- Мышьяк
- Сурьма
- Теллур
- Полоний
- Астатин
Метод 2 из 3: Анализ химических характеристик
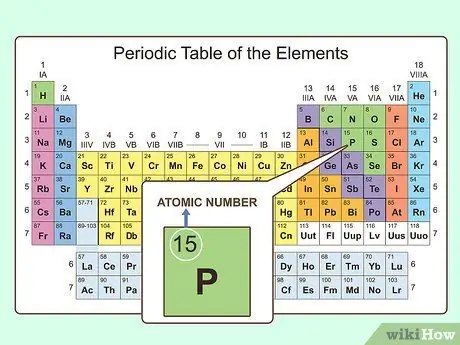
Шаг 1. Посмотрите порядок в таблице
Когда вы посмотрите на таблицу Менделеева, вы заметите, что все элементы пронумерованы. Эта нумерация далеко не случайна. Фактически, он известен как атомный номер для этого конкретного элемента и равен количеству протонов, которые элемент имеет в своем ядре.
- Для атомов (не ионов) атомный номер также представляет собой количество электронов в атоме. Число протонов и электронов в атоме равно.
- В некоторых таблицах Менделеева вы заметите второе число, выделенное более мелким шрифтом. Это средняя атомная масса этого элемента.

Шаг 2. Визуализируйте валентные электроны
Валентные электроны - это электроны во внешней оболочке электронного облака атома. Валентные электроны являются самым большим фактором химической реакции атома. Самая стабильная конфигурация атома - это заполнение его внешней оболочки электронами, поэтому он не будет связываться с другими атомами. В большинстве случаев внешняя оболочка должна содержать восемь электронов, чтобы быть заполненной (это может варьироваться в зависимости от размера атома).
- Например, у фтора девять электронов. Первые два заполняют самую внутреннюю орбиталь, остальные семь - валентные электроны. Это означает, что фтору нужен только еще один электрон, чтобы заполнить свою валентную оболочку. Таким образом, фтор легко реагирует с атомами, которые могут отдавать электрон (особенно с металлами).
- Пример обратного - литий. Литий имеет три электрона. Первые два заполняют самую внутреннюю оболочку, а последний - валентный электрон. Поскольку литию необходимо получить семь электронов, чтобы заполнить свою валентную оболочку, ему легче (более выгодно с энергетической точки зрения) избавиться от одного валентного электрона, который у него есть. Итак, литий легко реагирует с элементами, которые принимают электрон (например, галогенами).
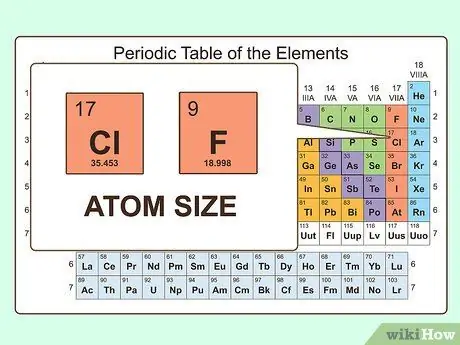
Шаг 3. Рассмотрим размер атома
Хотя валентные электроны являются лучшим показателем химических свойств данного атома, размер атома также имеет значение. У более крупных атомов больше электронов между ядром и валентными электронами, а это означает, что они прикрепляются к атому слабее, чем к меньшим атомам. Это объясняет, почему два атома с одинаковым числом валентных электронов (например, фтор и хлор) имеют схожие, но не идентичные химические свойства.
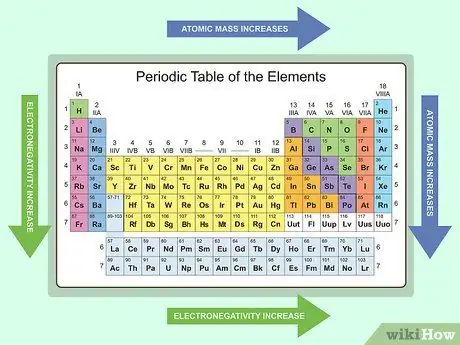
Шаг 4. Изучите тенденции таблицы Менделеева
Знание периодических тенденций может помочь вам распознать вероятные химические свойства элемента на основе его местоположения в периодической таблице. Однако важно помнить, что три группы (благородные газы, лантаноиды и актиниды) не следуют этим тенденциям из-за их уникального химического состава. Вот некоторые периодические тенденции:
- Атомная масса увеличивается слева направо и сверху вниз.
- Атомный радиус уменьшается слева направо и увеличивается сверху вниз.
- Электроотрицательность увеличивается слева направо и уменьшается сверху вниз.
- Энергия ионизации увеличивается слева направо и уменьшается сверху вниз.
- Сродство к электрону увеличивается слева направо и уменьшается сверху вниз.
- Металлический характер уменьшается слева направо и увеличивается сверху вниз.
Метод 3 из 3: изучение физических атрибутов
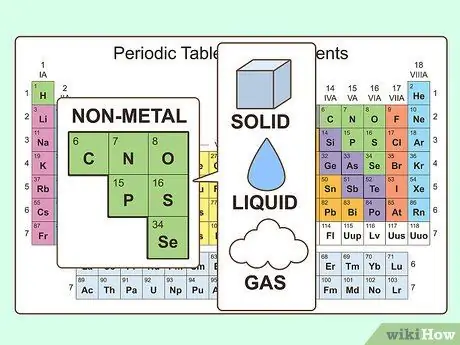
Шаг 1. Определите неметаллические свойства
Неметаллы существуют в трех физических состояниях при комнатной температуре (твердое, жидкое и газообразное), но в основном это газы при комнатной температуре. Неметаллы обычно тусклые и хрупкие, когда они твердые, и они обычно плавятся и кипят при более низких температурах, чем металлы. Неметаллы также плохо проводят тепло и электричество.
- Единственный неметалл, который является жидкостью при комнатной температуре, - это бром.
- Углерод имеет самую высокую температуру плавления из всех элементов.
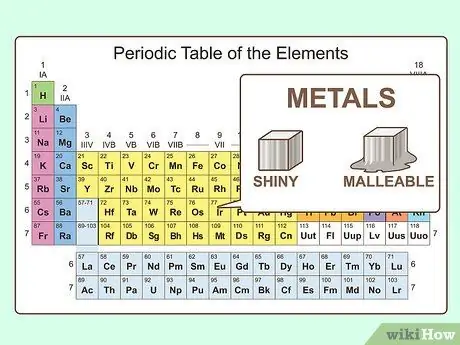
Шаг 2. Знать физические свойства металлов
Металлы блестящие и податливые. Также они хорошо проводят тепло и электричество. Металлы в основном твердые при комнатной температуре, хотя ртуть - жидкость. Металлы обычно имеют более высокие температуры плавления и кипения по сравнению с неметаллами.
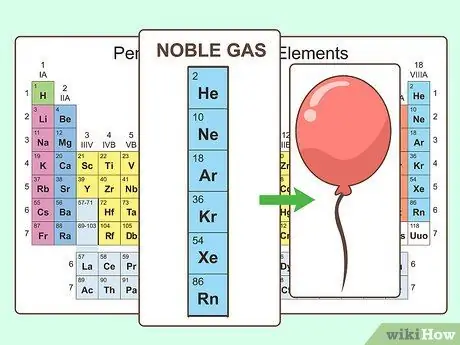
Шаг 3. Обратите внимание на благородные газы
Элементы, составляющие крайний правый столбец, известны как благородные газы. Они химически инертны и все находятся в газовой фазе при комнатной температуре. Эти газы используются для наполнения воздушных шаров и освещения вывесок.
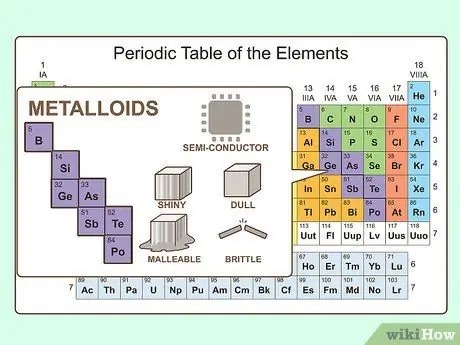
Шаг 4. Рассмотрим металлоиды
Подобно тому, как металлоиды обладают химическими свойствами как металлов, так и неметаллов, они обладают физическими свойствами обоих. Они полупроводники. Они могут быть пластичными или хрупкими. Также они могут быть блестящими или матовыми.
подсказки
- Вы можете делать карточки для изучения различных групп элементов.
- Если вам разрешено использовать периодическую таблицу на экзаменах и тестах, вы можете использовать ее, чтобы найти ответы на многие вопросы.